El cáncer continúa siendo una de las principales causas de mortalidad a nivel mundial, lo que ha motivado la búsqueda constante de terapias innovadoras que puedan mejorar la eficacia de los tratamientos actuales y reducir sus efectos secundarios. En los últimos años, la comprensión del metabolismo tumoral ha abierto nuevas vías para combatir esta enfermedad, enfocándose en la vulnerabilidad metabólica de las células cancerosas. Una de las estrategias más prometedoras en este campo es la implantación de adipocitos modificados, específicamente diseñados para competir por nutrientes clave y así limitar el avance tumoral. Los tumores, dada su rápida proliferación, demandan una cantidad elevada de nutrientes como glucosa y ácidos grasos para sostener su crecimiento y sobrevivencia. Sin embargo, las células cancerosas se encuentran dentro de un ecosistema complejo conocido como microambiente tumoral, caracterizado por ser hipóxico y limitado en recursos.
Gracias a su capacidad de reprogramar sus rutas metabólicas, las células malignas optimizan la captación y utilización de estos recursos, favoreciendo procesos como la glucólisis aeróbica, conocida como efecto Warburg, y el aumento de la oxidación de ácidos grasos en condiciones de hipoxia. Este fenómeno plantea un desafío terapéutico pero también una oportunidad: si se logra limitar el acceso a dichos nutrientes, se podría frenar el crecimiento tumoral. En este contexto, los adipocitos, las células grasas encargadas del almacenamiento y liberación de energía, emergen como aliados terapéuticos innovadores. La particularidad del tejido adiposo blanco radica en su capacidad para transformarse en un tejido semejante al adiposo marrón —que tiene una alta actividad metabólica— mediante un proceso llamado browning o beiging. Este cambio aumenta la absorción de glucosa y ácidos grasos para su metabolismo energético, lo que puede emplearse para competir con las células cancerosas por estos nutrientes esenciales.
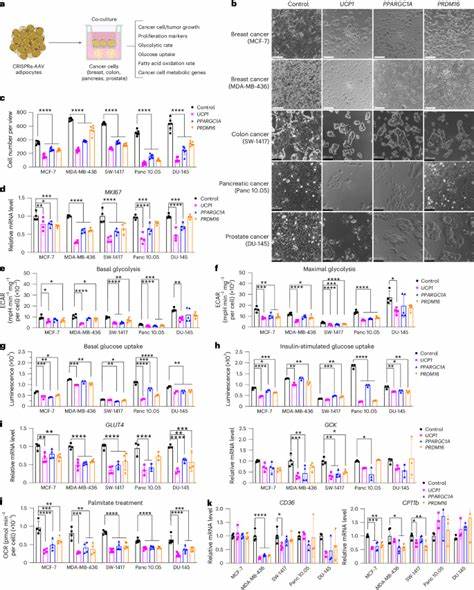
Investigadores han desarrollado una tecnología pionera denominada transplantación mediante manipulación adiposa o AMT (Adipose Manipulation Transplantation). Esta consiste en extraer adipocitos blancos, estimular genéticamente su transformación en adipocitos beige o marrones a través de la activación de genes clave como el UCP1 (proteína desacoplante 1), y luego implantar estos adipocitos modificados junto a tumores o tejidos afectados. La activación del gen UCP1, esencial para la termogénesis y el aumento de metabolismo en el tejido adiposo marrón, hace que estos adipocitos tengan una elevada tasa de consumo de glucosa y ácidos grasos, generando así una competencia metabólica directa con las células malignas. Estudios in vitro demostraron que la co-cultura de células cancerosas con adipocitos humanos modificados mediante la activación del UCP1 reduce significativamente la proliferación de diferentes líneas tumorales, como mama, colon, páncreas y próstata. Estos efectos se relacionan con la disminución de la captación de glucosa y la actividad metabólica de la glucólisis y la oxidación de ácidos grasos en las células tumorales.
Además, los órganos tumorales presentan menor expresión de marcadores proliferativos como MKI67, lo que indica una menor tasa de replicación celular. Los resultados preclínicos en modelos animales avalan aún más el potencial de AMT. En ratones inmunodeficientes implantados con xenoinjertos de células tumorales humanas, la coimplantación de organoides adiposos modificados supuso una reducción del tamaño tumoral superior al 50%. Estos efectos se acompañan de una disminución notable de la hipoxia tumoral y la angiogénesis, dos factores críticos que favorecen el crecimiento y la metastasis del cáncer. La implantación de estos organoides también condujo a niveles plasmáticos reducidos de insulina, una hormona que puede actuar como factor de crecimiento para ciertos tumores, sugiriendo un impacto sistémico en el metabolismo que contribuye a la supresión tumoral.
Un aspecto innovador de esta estrategia es la posibilidad de personalizar la modulación metabólica según las características específicas del tumor. Por ejemplo, los investigadores lograron modificar adipocitos para aumentar la expresión del gen UPP1 (uridina fosforilasa 1), una enzima que degrada uridina. En cánceres dependientes del metabolismo de nucleótidos, como el adenocarcinoma ductal pancreático, esta adaptación permite que los adipocitos compitan exitosamente por la uridina en el microambiente tumoral, restringiendo otro recurso fundamental para la proliferación tumoral. Además, la tecnología emplea métodos avanzados de activación génica mediante CRISPRa (activación CRISPR), que permiten regular la expresión de los genes deseados de forma específica y controlada. Este sistema puede incorporarse en vectores virales de tipo AAV, facilitando la transducción de células adiposas maduras o sus precursores.
Para mejorar la seguridad y la aplicabilidad clínica, se han desarrollado sistemas inducibles que permiten activar la expresión génica solo en presencia de fármacos como la tetraciclina, brindando un control fino sobre la actividad terapéutica y reduciendo riesgos potenciales. La integración de los adipocitos modificados en dispositivos de entrega basados en andamios celulares o scaffold permite asimismo una implantación estable y reversible. Estos dispositivos pueden posicionarse cercana o distalmente al tumor, demostrando que la competencia metabólica puede darse incluso a distancia, lo cual es relevante para tumores de difícil acceso quirúrgico. La posibilidad de remover o reemplazar fácilmente estos andamios acentúa la flexibilidad de la terapia y su personalización según la evolución del paciente. Una ventaja importante del enfoque AMT es su traslacionalidad.
La obtención de adipocitos mediante liposucción o del tejido adiposo resecado durante cirugías reconstructivas supone procedimientos clínicos rutinarios y seguros. Esto permite que los adipocitos puedan ser modificados ex vivo y luego implantados de nuevo en el mismo paciente —un enfoque autólogo que reduce reacciones inmunitarias y mejora la aceptación—. En particular, la aplicación en cáncer de mama, donde la reconstrucción post-mastectomía es habitual, ofrece una oportunidad concreta para implementar esta estrategia terapéutica. Estudios con adipocitos humanos aislados de tejidos mamarios confirmaron la posibilidad de modificar estas células para aumentar la expresión de UCP1 y demostrar un efecto supresor sobre cultivos de organoides tumorales derivados de pacientes. Esta evidencia fortalece la idea de que AMT puede ser utilizada en tratamientos personalizados y adaptados a la biología específica del tumor de cada paciente.
El reto de la posible aparición de caquexia, una condición metabólica que implica pérdida severa de masa grasa y muscular asociada a algunos cánceres y vinculada a la activación aumentada del tejido adiposo marrón, debe considerarse cuidadosamente. No obstante, la posibilidad de controlar la actividad de los adipocitos implantados mediante sistemas inducibles o la remoción segura del andamio implícito otorga un margen de seguridad importante para minimizar riesgos clínicos. Esta innovadora línea terapéutica representa un paradigma distinto al de los tratamientos convencionales centrados únicamente en atacar las células tumorales. Al modificar el ecosistema metabólico que rodea al tumor, se consigue un efecto indirecto pero potente de supresión tumoral. Además, dada la heterogeneidad metabólica entre diferentes tipos de cáncer, las posibilidades de personalización del enfoque AMT mediante la modulación de diversas rutas metabólicas son amplias y prometedoras.
En conclusión, la implantación de adipocitos modificados funcionalmente mediante técnicas genéticas como CRISPRa constituye una estrategia emergente con gran potencial para mejorar el tratamiento del cáncer. Su capacidad para competir por nutrientes esenciales, restringiendo así el crecimiento tumoral, combinada con su adaptabilidad y viabilidad clínica, abren nuevas perspectivas en la oncología moderna. El avance hacia ensayos clínicos aportará mayor evidencia y establecerá el camino para el uso de la manipulación adiposa como terapia complementaria o incluso principal, en la batalla contra el cáncer.