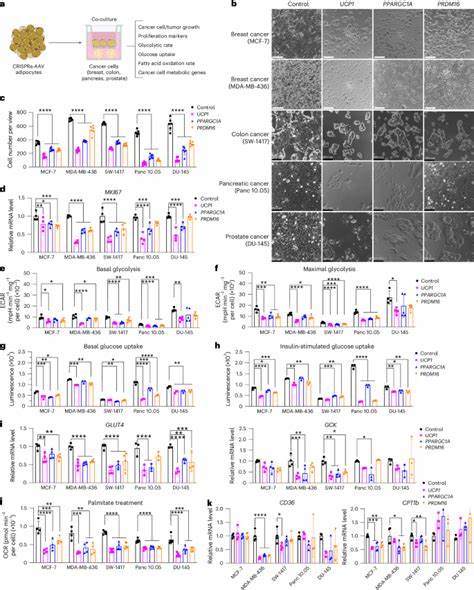
El cáncer continúa siendo uno de los mayores desafíos para la medicina contemporánea, impulsando una constante búsqueda de tratamientos innovadores que sean efectivos y menos invasivos. En este contexto, la reciente investigación sobre la implantación de adipocitos modificados genéticamente ha abierto una puerta prometedora en la lucha contra el avance tumoral. Estos adipocitos ingenierizados, mediante técnicas avanzadas de edición genética, demuestran un notable potencial para suprimir el crecimiento de tumores en modelos experimentales de cáncer, ofreciendo una estrategia inédita basada en la manipulación metabólica del microambiente tumoral. La base del enfoque reside en la competencia metabólica. Las células cancerosas requieren grandes cantidades de nutrientes, fundamentalmente glucosa y ácidos grasos, para sostener su rápido crecimiento y proliferación.
Este metabolismo alterado se manifiesta en fenómenos como el efecto Warburg, en el cual las células tumorales prefieren la glucólisis aeróbica para obtener energía, incluso en presencia de oxígeno. Lo que plantea la interrogante: ¿es posible limitar la disponibilidad de estos nutrientes al tumor para frenar su desarrollo sin dañar a las células normales? Es aquí donde los adipocitos modificados entran en escena. Las células adiposas, responsables del almacenamiento y manejo de lípidos y glucosa, pueden ser manipuladas para aumentar su capacidad metabólica, incrementando su consumo de glucosa y ácidos grasos. Utilizando tecnologías como CRISPR activador (CRISPRa), los investigadores han logrado potenciar la expresión de genes clave en los adipocitos, tales como UCP1, PPARGC1A y PRDM16, que están relacionados con la transformación del tejido adiposo blanco a un fenotipo similar al tejido adiposo marrón, conocido por su alta actividad metabólica y su capacidad para disipar energía en forma de calor. El aumento de la actividad metabólica en estos adipocitos transforma su perfil funcional, incrementando la captación y oxidación de glucosa y grasas.
Al implantarse junto a células o xenoinjertos tumorales, estos adipocitos efectúan una competencia directa por nutrientes esenciales, limitando la disponibilidad de recursos para las células cancerosas y generando un entorno hipóxico y pobre en nutrientes que inhibe su proliferación. En estudios in vitro, la co-cultivación de adipocitos modificados con distintos tipos de células tumorales, incluyendo cáncer de mama, colon, páncreas y próstata, ha demostrado una reducción significativa en la proliferación celular. Además, el análisis metabólico revela una disminución tanto en la glucólisis como en la oxidación de ácidos grasos en las células cancerosas al estar en presencia de estos adipocitos metabolizadores intensificados. Los resultados se refuerzan en modelos animales. En ratones inmunodeficientes con tumores implantados, la co-transplante de adipocitos marrones modificados genera una reducción notable en el tamaño tumoral, comparado con controles.
Es especialmente importante destacar que este efecto antitumoral va acompañado de una reducción en marcadores de proliferación celular como Ki67, menor angiogénesis, disminución de la hipoxia tumoral y aumento de apoptosis en los tejidos cancerosos. Un aspecto relevante es la aplicabilidad de esta tecnología de manera personalizada. Los adipocitos pueden ser extraídos directamente del paciente mediante procedimientos clínicos comunes, como la liposucción, manipulados ex vivo y luego reimplantados cerca del tumor o incluso en ubicaciones distales, donde parecen ejercer efectos sistémicos que también contribuyen a limitar el avance del cáncer. Esto abre la posibilidad de terapias autólogas con bajo riesgo de rechazo inmunológico y adaptables a diferentes tipos de tumores. Otro avance importante ha sido el desarrollo de sistemas controlables que permiten activar o desactivar la función metabólica de los adipocitos modificados mediante la administración de tetraciclinas, logrando un control temporal de la terapia y reduciendo posibles efectos secundarios.
Asimismo, la incorporación de adipocitos en plataformas de andamiaje celular fabricadas con polímeros biodegradables facilita su transporte, implantación y futura extracción, optimizando la seguridad y flexibilidad del tratamiento. Los investigadores también han explorado la personalización del enfoque para distintos perfiles metabólicos tumorales. Por ejemplo, en el caso del adenocarcinoma pancreático ductal, que depende mayoritariamente del uridina para su metabolismo, se ha empleado la ingeniería genética para aumentar la expresión de la enzima uridina fosforilasa 1 (UPP1) en los adipocitos, incrementando su consumo de uridina y superando a las células tumorales, resultando en una supresión eficaz del crecimiento tumoral. Este nuevo paradigma terapéutico, denominado Transplante de Manipulación Adiposa (AMT por sus siglas en inglés), constituye una alternativa potencial para complementar y potenciar las terapias convencionales contra cáncer, incluyendo cirugía, quimioterapia y radioterapia. La posibilidad de modificar el metabolismo tumoral a través de la competencia para los nutrientes supone un cambio radical en la manera de abordar el microambiente tumoral.
Sin embargo, como con toda terapia novedosa, existen retos y consideraciones. Es necesario entender en profundidad la dinámica entre los adipocitos modificados y las células cancerosas, así como los posibles efectos sistémicos que la activación sostenida de adipocitos marrones o beige pueda tener, especialmente en el contexto del balance energético general y riesgos como la caquexia cancerosa. La modularidad y el control de la terapia, ya probados mediante sistemas inducibles y dispositivos de implantación removibles, resultan esenciales para abordar estos desafíos clínicos. Además, se requieren estudios clínicos que validen la seguridad, eficacia y tolerancia en humanos, además de optimizar protocolos para la obtención, modificación, cultivo y reimplantación de adipocitos en condiciones clínicas estándares. La integración de esta terapia con nanomedicina, vectores virales no integrativos y técnicas avanzadas de cultivo tridimensional promete mejorar aún más su aplicabilidad y resultados.
El impacto de esta tecnología puede extenderse también a la prevención, especialmente en individuos con predisposición genética a ciertos tipos de cáncer, como el cáncer de mama en portadoras de mutaciones BRCA1/BRCA2, donde la implantación de adipocitos modificados ha mostrado reducir la proliferación premaligna en organoides derivados de tejidos humanos. En definitiva, la implantación de adipocitos ingenierizados para competir por recursos metabólicos esenciales representa un avance disruptivo en oncología. A medida que se profundice el conocimiento sobre el metabolismo tumoral y la interacción con el microambiente, esta estrategia de manipulación celular tiene el potencial de integrarse como un componente fundamental para tratamientos personalizados, menos tóxicos y altamente efectivos contra el cáncer. La combinación de ingeniería genética, biología celular y biomateriales abre una nueva frontera en la guerra contra esta enfermedad que, sin duda, merece atención, inversión y desarrollo acelerado.