El cáncer es una de las enfermedades más desafiantes y complejas del siglo XXI, debido a su capacidad para adaptarse, proliferar rápidamente y resistir tratamientos convencionales. Entre las diversas características que hacen que los tumores sean tan agresivos destacan su elevada demanda metabólica y su habilidad para reprogramar rutas energéticas con el fin de asegurar su supervivencia y crecimiento. En este contexto, surge una innovadora estrategia terapéutica basada en la implantación de adipocitos modificados genéticamente, que ha demostrado su eficacia para suprimir el progreso tumoral en diferentes modelos de cáncer. La manipulación metabólica de estos adipocitos abre una ventana prometedora para nuevos tratamientos contra el cáncer, ofreciendo esperanza para múltiples tipos tumorales. Los tumores, a diferencia de las células normales, requieren un suministro constante y elevado de nutrientes como glucosa y ácidos grasos para mantener su rápida proliferación.
Este fenómeno se explica en parte por el conocido efecto Warburg, por el cual las células cancerosas prefieren la glicólisis aeróbica para producir energía, incrementando considerablemente su captación de glucosa y la producción de lactato. Además, en condiciones de hipoxia, característica del microambiente tumoral, las células malignas aumentan la utilización de lípidos debido a la mayor eficiencia energética que ofrecen los ácidos grasos. Esta dependencia metabólica ha llevado a la búsqueda de tratamientos que aborden la regulación del metabolismo tumoral, sin embargo, muchos fármacos dirigidos a rutas específicas han presentado limitaciones por su eficacia y toxicidad. En respuesta a esta problemática, un grupo de investigadores introdujo el concepto denominado "trasplante de manipulación adiposa" o AMT (por sus siglas en inglés), que consiste en implantar adipocitos modificados genéticamente para incrementar su capacidad metabólica y, así, competir directamente con las células tumorales por los nutrientes disponibles. Esta competencia por recursos esenciales reduce la disponibilidad para el tumor, impidiendo su proliferación y progresión.
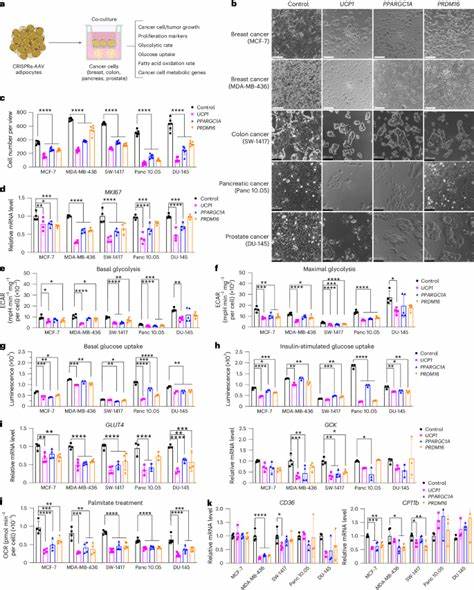
Estos adipocitos modificados se obtienen mediante la activación por CRISPRa de genes clave relacionados con la función del tejido adiposo marrón, conocido por su capacidad de disipar energía en forma de calor gracias a proteínas como UCP1 (proteína desacoplante 1). La sobreexpresión de UCP1 en adipocitos blancos genera un fenómeno denominado "marronización" o "beiging", que transforma estas células en unidades similares al tejido marrón, capaces de aumentar significativamente su consumo de glucosa y oxidación de ácidos grasos. De esta manera, los adipocitos modificados actúan como auténticos motores metabólicos, que absorben grandes cantidades de nutrientes, privando al tumor de los recursos necesarios para su crecimiento. En modelos in vitro, la co-cultivación de adipocitos inducidos al beige con diferentes líneas celulares cancerosas, tales como cáncer de mama, colon, páncreas y próstata, mostró una reducción significativa en la proliferación tumoral y en la expresión de marcadores asociados a la glicólisis y oxidación de ácidos grasos. Estos resultados evidencian que la competencia metabólica entre las células modificadas y las cancerosas es suficiente para inhibir la expansión tumoral, sin necesidad de contacto físico directo, sugiriendo la efectividad de metabolitos o factores solubles en esta interacción.
La eficacia del AMT fue validada en modelos animales xenoinjertados, donde la implantación de organoides adiposos modificados junto a tumores desarrollados en ratones inmunodeficientes redujo el tamaño tumoral, la angiogénesis y las condiciones de hipoxia típicas del microambiente tumoral. Adicionalmente, se observó un incremento en la apoptósis celular tumoral, reflejado en niveles elevados de caspasas activadas. Estas pruebas sugieren que los adipocitos marronizados no solo restringen la disponibilidad de nutrientes, sino que también alteran el microambiente favoreciendo la inhibición del progreso tumoral. Los organoides adiposos, estructuras tridimensionales que reproducen la complejidad y heterogeneidad del tejido adiposo, demostraron ser una plataforma excelente para la implantación y estudio in vivo. Su capacidad para mantener la función metabólica y su integración eficiente en los tejidos hospederos brindan ventajas sobre el trasplante de adipocitos aislados.
La utilización de vectores adenoasociados (AAV9) para la entrega de la maquinaria CRISPRa permitió una modulación eficaz y sostenida de los genes seleccionados, garantizando un estado funcional adecuado de las células implantadas. Asimismo, estudios realizados con modelos genéticos murinos de cáncer de páncreas y mama confirmaron la eficacia de esta estrategia para la prevención y supresión de tumores en contextos fisiológicos más complejos. Los resultados incluyeron una disminución significativa en la masa tumoral, mayor sensibilidad a la insulina y mejoría en la tolerancia a la glucosa, evidenciando beneficios sistémicos además del efecto directo sobre el tumor. Un aspecto fundamental de esta tecnología es su potencial personalización. Por ejemplo, ante tumores con dependencia metabólica particular, como el carcinoma ductal pancreático que utiliza uridina como fuente energética, los adipocitos pueden ser modificados para sobreexpresar enzimas como UPP1 (uridina fosforilasa 1).
Esta enzimática permite la competencia efectiva por uridina, restringiendo el acceso tumoral a este metabolito y enfriando su capacidad de crecimiento, lo que demuestra que el AMT puede ser adaptado y modular su acción según las características metabólicas del tumor específico. Desde una perspectiva clínica, la posibilidad de extraer adipocitos del propio paciente mediante técnicas mínimamente invasivas, modificarlos ex vivo y reimplantarlos, hace de esta estrategia una alternativa viable y menos tóxica que los tratamientos convencionales. En particular, para el cáncer de mama, donde se suelen practicar procedimientos reconstructivos mediante trasplantes de tejido adiposo, la manipulación previa de estas células podría maximizar el beneficio terapéutico y minimizar la recurrencia. Otra innovación deriva de la creación de sistemas inducibles y reversibles para controlar la expresión de genes en los adipocitos modificados. El uso de vectores Tet-On, activados por administración de doxiciclina, permite encender o apagar la capacidad metabólica aumentada a voluntad, lo que abre la puerta a estrategias terapéuticas más seguras y adaptables en función del progreso tumoral o la aparición de efectos adversos.
La implementación de plataformas de implantación basadas en andamios o scaffolds biodegradables también mejora la gestión y administración de los organoides adiposos, facilitando su integración y permitiendo su extracción o reemplazo si fuera necesario, lo que brinda un mayor control clínico sobre la terapia. La implantación de adipocitos modificados para competir con las células tumorales representa un viraje en la forma en que se aborda la oncología metabólica. Esta estrategia no busca dañar directamente las células malignas, sino crear un escenario hostil de competencia por nutrientes esenciales, limitando la capacidad tumoral para sostener su rápido crecimiento. Esto reduce la probabilidad de desarrollo de resistencias y podría combinarse con otras terapias como quimioterapia, inmunoterapia o radioterapia para multiplicar su efecto. Sin embargo, se deben considerar aspectos complejos propios de la fisiología y patología oncológica, como el riesgo de caquexia asociada al cáncer, dado que adipocitos altamente metabólicos podrían incrementar la pérdida de masa corporal si no se controlan adecuadamente.
Por ello, el desarrollo de sistemas regulables e implantables es crucial para asegurar la seguridad y efectividad de estos tratamientos. Además, la relación entre el tejido adiposo, obesidad y cáncer es multifacética. Si bien la obesidad es un factor de riesgo para múltiples tipos de cáncer, la manipulación dirigida del tejido adiposo para transformarlo en una herramienta terapéutica contra el cáncer representa un enfoque innovador y contrapuesto a las percepciones tradicionales, subrayando el potencial del tejido adiposo como un órgano activo y modulable en la lucha clínica. En resumen, la implantación de adipocitos modificados para aumentar su consumo metabólico y competir con las células tumorales representa una prometedora estrategia terapéutica que ha demostrado eficacia en modelos preclínicos de cáncer. Su capacidad para ser personalizada, regulada y combinada con otras terapias, así como su base en tecnologías genéticas avanzadas y procedimientos clínicos existentes, la posicionan como un enfoque emergente para mejorar la respuesta al cáncer y abrir nuevas vías para la medicina personalizada.
El desarrollo futuro, con ensayos clínicos controlados y estudios funcionales adicionales, determinará su impacto en la práctica clínica y su contribución a la lucha contra esta devastadora enfermedad.