El Alzheimer es una de las enfermedades neurodegenerativas más devastadoras de nuestro tiempo, afectando aproximadamente a una de cada nueve personas mayores de 65 años. Esta enfermedad no solo causa deterioro cognitivo progresivo, sino que también genera un aumento significativo en la ansiedad entre los pacientes. A pesar de décadas de investigación, los tratamientos actuales ofrecen resultados limitados y muchas interrogantes aún persisten, especialmente en relación con las causas del Alzheimer espontáneo, que no depende de mutaciones genéticas conocidas. Un avance reciente en este campo ha sido posible gracias a la aplicación innovadora de la inteligencia artificial (IA) en la investigación biomédica, lo que ha permitido identificar una causa subyacente en el desarrollo de la enfermedad y descubrir un fármaco candidato con potencial terapéutico. La investigación, liderada por el profesor Sheng Zhong en la Universidad de California en San Diego (UCSD), se centra en el gen conocido como fosfoglicerato deshidrogenasa (PHGDH), cuya función dual fue desconocida hasta ahora y que podría transformar nuestra comprensión y tratamiento del Alzheimer.
Durante años, PHGDH fue conocido únicamente por su rol en la producción del aminoácido serina, esencial para diversas funciones metabólicas y neurotransmisoras. Sin embargo, su vinculación con el Alzheimer se mantenía en el terreno de la correlación, sin un vínculo causal claramente establecido. Estudios anteriores detectaron que los niveles de expresión de PHGDH aumentan de forma significativa en pacientes con Alzheimer, pero el mecanismo a través del cual este gen contribuía a la patología permanecía un misterio. La incapacidad de demostrar que la actividad enzimática de PHGDH estuviera relacionada con el empeoramiento de la enfermedad hizo que la investigación se estancara temporalmente. La solución a esta encrucijada llegó gracias a la inteligencia artificial aplicada a la biología estructural.
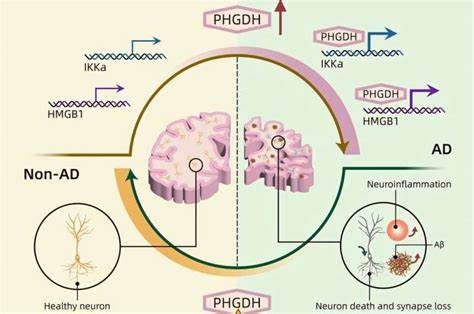
Mediante modelos computacionales avanzados, los investigadores pudieron visualizar la estructura tridimensional de la proteína producida por PHGDH y detectaron una subestructura inesperada que funciona como un dominio de unión al ADN. Esta característica es peculiar porque no se corresponde con la secuencia clásica del dominio, sino que solo se evidencia en la configuración tridimensional, lo cual solo pudo descubrirse gracias a las capacidades analíticas de la IA. Esta inesperada función, llamada “moonlighting” o función secundaria, indica que PHGDH no solo participa en la producción metabólica de serina, sino que también regula la actividad de ciertos genes críticos en el cerebro. Esta regulación anómala altera el equilibrio genético en las células cerebrales, perturbando procesos esenciales para su correcto funcionamiento y provocando el inicio y la progresión de la enfermedad de Alzheimer, especialmente en casos espontáneos sin mutaciones genéticas definidas. Los experimentos realizados en modelos animales y organoides cerebrales humanos confirmaron que la cantidad de proteína PHGDH afecta directamente la evolución del Alzheimer.
La reducción de su expresión se traduce en una disminución de la progresión de la enfermedad, mientras que su aumento acelera los síntomas y el deterioro cognitivo. Estos hallazgos implican que los niveles de PHGDH pueden ser un desencadenante causal crítico en el Alzheimer espontáneo, ofreciendo un nuevo objetivo para terapias más efectivas. Aprovechando también la inteligencia artificial para modelar interacciones moleculares, el equipo de UCSD identificó un compuesto pequeño, conocido como NCT-503, que podría inhibir esta función reguladora secundaria de PHGDH sin afectar su rol metabólico esencial. Esta capacidad específica es crucial porque evita posibles efectos secundarios derivados de interferir con la producción de serina. Además, NCT-503 tiene la capacidad de atravesar la barrera hematoencefálica, una propiedad indispensable para cualquier medicamento que deba actuar dentro del cerebro.
Las pruebas en ratones con modelos de Alzheimer mostraron resultados prometedores. Los animales tratados con NCT-503 evidenciaron mejoras significativas en pruebas de memoria y reducción de ansiedad, síntomas esenciales que reflejan la experiencia humana con la enfermedad. Si bien estos modelos no replican por completo la complejidad del Alzheimer espontáneo, constituyen un paso importante hacia una posible intervención clínica. Este enfoque terapéutico representa una desviación clave de los tratamientos tradicionales que se dirigían principalmente a remover placas beta-amiloides, las depósitos tóxicos asociados con la enfermedad. Investigaciones recientes sugieren que intervenir en etapas tardías del trastorno, cuando las placas ya están formadas, puede ser insuficiente para modificar el curso de la patología.
Por el contrario, la interferencia temprana en la regulación genética provocada por PHGDH podría prevenir la formación y acumulación de estas placas, ofreciendo un enfoque más preventivo y potencialmente más efectivo. El descubrimiento y la validación de la función reguladora de PHGDH en el Alzheimer son una prueba del poder de la inteligencia artificial para transformar la investigación médica. Al permitir una visión detallada de la estructura molecular y las interacciones biológicas complejas, la IA abrió una ventana para identificar mecanismos celulares que antes eran invisibles y formular terapias inesperadas. Además del potencial para cambiar el tratamiento del Alzheimer, este hallazgo destaca el valor de combinar la computación avanzada con la bioingeniería y la neurociencia para acelerar descubrimientos que tradicionalmente podían tomar décadas. Aun así, los investigadores reconocen que queda mucho camino por recorrer antes de que este compuesto pueda ser utilizado en humanos, incluyendo la optimización de su eficacia, seguridad y la realización de estudios clínicos rigurosos.
La investigación ya se está dirigendo hacia la preparación para los estudios de clínica reguladora (IND, por sus siglas en inglés) que son esenciales para la aprobación por parte de entidades como la FDA. Otro punto a destacar es la oportunidad que brindan las pequeñas moléculas como NCT-503 para ofrecer tratamientos más accesibles y menos invasivos que las terapias actuales, muchas de las cuales requieren infusiones o procedimientos clínicos complejos. La administración oral de un medicamento efectivo podría mejorar notablemente la calidad de vida de los pacientes. En conclusión, la convergencia de la inteligencia artificial con la investigación biomédica ha resultado en un avance significativo para entender una forma común pero poco comprendida de Alzheimer. La revelación de que PHGDH no sólo es un marcador sino un agente causal mediante su función secundaria afecta cómo se desarrollarán futuras estrategias terapéuticas.
Los avances logrados por el equipo de UCSD ofrecen esperanza no solo para retardar la progresión de la enfermedad, sino también para prevenirla desde etapas muy tempranas, lo que representa un cambio de paradigma en la lucha contra el Alzheimer. La continua colaboración multidisciplinaria, junto con las tecnologías emergentes, promete seguir abriendo caminos en la búsqueda de curas para enfermedades complejas y devastadoras, donde la inteligencia artificial jugará un papel protagonista como aliado imprescindible para descifrar los secretos del cerebro humano.