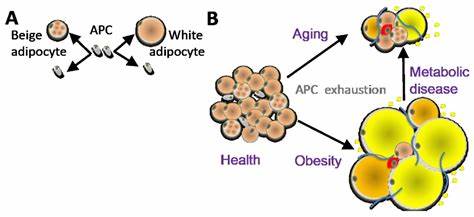
El aumento de peso y la acumulación de grasa, especialmente en la región visceral del cuerpo, son fenómenos comunes durante la etapa media de la vida y en el envejecimiento temprano. Este proceso no solo impacta la apariencia física sino que también está estrechamente relacionado con diferentes patologías metabólicas, como la resistencia a la insulina y la diabetes tipo 2. A pesar de su importancia clínica, las bases celulares y moleculares que subyacen a la expansión del tejido adiposo visceral durante el envejecimiento han permanecido en gran medida desconocidas hasta fechas recientes. Avances científicos recientes han revelado la existencia de una población particular de células progenitoras adiposas que emergen con la edad y que son las responsables de conducir una adipogénesis activa en esta etapa de la vida. El tejido adiposo no es simplemente un depósito pasivo de energía, sino que es un órgano dinámico que desempeña múltiples funciones endocrinas y metabólicas vitales.
Adipogénesis se refiere al proceso mediante el cual nuevas células adiposas se generan a partir de células progenitoras a través de su proliferación y diferenciación. En adultos jóvenes, el recambio de adipocitos es bajo, especialmente en el tejido visceral; sin embargo, durante la mediana edad y el inicio del envejecimiento, hay un aumento dramático en la generación de nuevos adipocitos en esta región. Este fenómeno se relaciona con la aparición de un tipo específico de células preadipocíticas comprometidas, conocidas como CP-As (Committed Preadipocytes - Age-enriched), que no sólo proliferan a un ritmo elevado sino que además poseen una capacidad diferenciativa sobresaliente. Estudios realizados en modelos animales, principalmente en ratones masculinos de mediana edad, han documentado que alrededor del 80% de los adipocitos presentes en el tejido adiposo visceral son nuevos, evidenciando un alto índice de renovación celular. Este proceso coincide con un aumento en la masa adiposa visceral y la presencia de adipocitos más pequeños, denominado hipotrofia adipocitaria.
Además, se observa una disminución en el gasto energético y una mayor predisposición a la resistencia a la insulina, factores que contribuyen al desarrollo de enfermedades metabólicas. Las CP-As identificadas mediante análisis de secuenciación de ARN de una sola célula son muy distintas en comparación con las células progenitoras presentes en adultos jóvenes. Estas células emergen principalmente en ratones a partir de los nueve meses, alcanzando un pico alrededor de los doce meses y disminuyendo marcadamente conforme avanza la edad hacia los 18 meses. La aparición de estas células está asociada con características funcionales únicas, tales como una alta proliferación y capacidad adipogénica incluso en cultivos tridimensionales y tras ser trasplantadas en animales jóvenes, evidenciando que su potencial no depende del microambiente sino que es una propiedad intrínseca de estas células. Un hallazgo crucial en la caracterización de estas CP-As es la identificación del receptor de factor inhibidor de leucemia (LIFR) como un marcador funcional indispensable para su adipogénesis.
La señalización mediada por LIFR es necesaria para la proliferación y diferenciación de estas células preadipocíticas específicas generadas con la edad. La inhibición farmacológica de LIFR previene la expansión del tejido adiposo visceral en ratones de mediana edad sin afectar la adipogénesis en células progenitoras jóvenes, lo que evidencia una especificidad de esta vía señalizadora para la población CP-A. Estos datos no solo proporcionan una ventana hacia los mecanismos celulares del aumento de la grasa visceral con la edad, sino que también sugieren posibles dianas terapéuticas para intervenir en esta condición. Importante es destacar que estas observaciones no se limitan a modelos animales, ya que estudios en tejido humano también han identificado células progenitoras similares con alta capacidad proliferativa y adipogénica, marcadas por LIFR. Además, el fenómeno de acumulación de grasa visceral y la aparición de esta población celular comprometida resultan ser específicos del sexo masculino y del sitio visceral, no encontrándose de forma destacada en el tejido adiposo subcutáneo ni en hembras, lo que subraya la complejidad y especificidad biológica de esta dinámica celular.
En términos generales, estos hallazgos revolucionan la comprensión tradicional del envejecimiento en el tejido adiposo. Mientras que la mayoría de las células madre adultas tienden a reducir su capacidad de proliferación y diferenciación con el tiempo, las CP-As muestran un comportamiento opuesto, adquiriendo una mayor potencialidad adipogénica con la edad. Esto desafía el paradigma convencional y abre nuevas perspectivas para entender cómo la composición y función del tejido adiposo cambian con la edad y el sexo. Las implicaciones clínicas de estos descubrimientos son de gran magnitud. La acumulación de grasa visceral se asocia con un mayor riesgo de enfermedades cardiovasculares, diabetes y otros trastornos metabólicos que deterioran la calidad y expectativa de vida.
El conocimiento sobre la población celular responsable y los mecanismos que regulan su actividad, como la vía LIFR, brinda oportunidades para el desarrollo de tratamientos dirigidos que puedan mitigar estos riesgos. Por ejemplo, el uso de inhibidores específicos de LIFR podría limitar la expansión de la grasa visceral durante la mediana edad, contribuyendo a la prevención de enfermedades metabólicas y promoviendo un envejecimiento más saludable. Asimismo, la especificidad del efecto de esta población celular en el tejido visceral y en ratones machos sugiere que el abordaje terapéutico podría ser personalizado considerando el sexo y la localización del tejido adiposo, optimizando así la eficacia y reduciendo posibles efectos adversos. Desde una perspectiva biológica fundamental, la aparición de una población de progenitores adiposos con alta capacidad proliferativa y diferenciativa en la mediana edad indica que el tejido adiposo mantiene una notable plasticidad con el tiempo. Esta plasticidad, aunque contribuye a la acumulación de grasa, también podría ser aprovechada en contextos de regeneración y reparación tisular si se entienden mejor sus mecanismos reguladores.
Además, la interrelación de estas células CP-A con otros aspectos del envejecimiento, como la inflamación y la senescencia celular, sigue siendo un área abierta para la investigación. Se sabe que el envejecimiento genera un microambiente inflamatorio crónico en los tejidos, y comprender cómo estas células progenitoras interaccionan con dicho entorno podría clarificar aún más la fisiopatología de la adiposidad visceral y sus consecuencias metabólicas. En conclusión, la identificación y caracterización de las células progenitoras adiposas específicas que emergen con la edad y que promueven una adipogénesis activa representan un avance esencial para entender la expansión del tejido adiposo visceral durante la mediana edad. El papel central de la señalización a través del receptor LIFR en este proceso destaca una potencial vía terapéutica para controlar la obesidad visceral y los trastornos relacionados en el envejecimiento. Estos datos no solo aportan claridad científica sino que también ofrecen esperanzas concretas para el desarrollo de estrategias que permitan promover una mejor salud metabólica y calidad de vida en la población adulta y envejeciente.
La investigación continua en este campo es vital para traducir estos descubrimientos en aplicaciones clínicas efectivas y personalizadas.