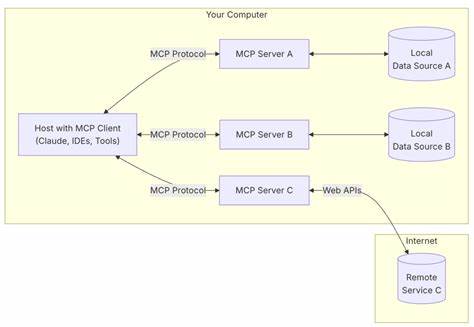
La predicción de la estructura de proteínas ha sido uno de los desafíos más complejos y apasionantes en la biología molecular. Con el lanzamiento de AlphaFold 2, DeepMind revolucionó el campo al ofrecer predicciones estructurales con una precisión sin precedentes. Sin embargo, la comunidad científica y tecnológica ya se plantea la siguiente gran pregunta: ¿qué podría traer AlphaFold 4? Esta interrogante engloba numerosas perspectivas y temas relacionados con la evolución de la biología computacional, el aprendizaje automático y la integración multidisciplinaria que podría definir la próxima generación de la predicción de proteínas. AlphaFold 4 podría representar la consolidación de un modelo unificado que integre la evolución, la conservación, la coevolución y la dinámica estructural de las proteínas. A diferencia de sus predecesores, que principalmente se apoyaron en información de múltiples secuencias alineadas para inferir las estructuras, esta nueva versión tendría que enfrentar retos más profundos relacionados con regiones ambiguas de las proteínas y aquellas para las cuales no existe información evolutiva suficiente.
Uno de los puntos centrales que se discuten sobre AlphaFold 4 es su capacidad para manejar tanto las secuencias no ambiguas como las ambiguas en las proteínas. Mientras que las primeros corresponden a regiones que son altamente conservadas y con estructuras bien definidas, las ambiguas son aquellas partes que adoptan conformaciones distintas según su contexto o función, y que son mucho más difíciles de predecir. Se espera que AlphaFold 4 implemente una estrategia híbrida que combine modelos basados en datos evolutivos para las regiones no ambiguas, y un enfoque más físico o basado en simulaciones moleculares para las regiones ambiguas, integrando incluso principios de dinámica molecular para capturar la flexibilidad y la función. En cuanto a la mecánica interna de AlphaFold 4, se rumorea que la próxima generación de modelos incluirá una capacidad mejorada para explorar múltiples «semillas» o puntos de inicio independientes durante el proceso de inferencia. Esta función permitirá que el modelo realice una búsqueda más global en el espacio conformacional, mitigando las limitaciones actuales de depender de un único punto de partida que restringe la exploración.
De esta forma, el modelo podrá identificar múltiples estructuras plausibles para una misma proteína, lo cual es especialmente útil en casos de regiones con flexibilidad o múltiples estados funcionales. Además, AlphaFold 4 podría incorporar mecanismos de retroalimentación más sofisticados durante su proceso de reciclaje. En versiones anteriores, el reciclaje servía para refinar la estructura predicha iterativamente, pero en AlphaFold 3 se notó cierta limitación, ya que el modelo no alimenta la estructura predicha de vuelta para ajustar las restricciones evolutivas y espaciales de manera eficiente. Una mejora en esta interacción permitirá que AlphaFold 4 evite conflictos como choques atómicos o incompatibilidades estructurales, aumentando la precisión especialmente en casos complejos como grandes complejos moleculares y oligómeros. Los desarrolladores de AlphaFold 4 también podrían enfocarse en una integración más profunda con datos experimentales y de laboratorio.
Por ejemplo, incluir información de afinidad de unión, cinética de plegamiento, mutagénesis dirigida y datos dinámicos de proteínas podría ayudar al modelo no solo a predecir la forma estática de una proteína, sino también a comprender cómo esa estructura funciona y varía en condiciones biológicas reales. Esto marcaría un paso hacia modelos de predicción más contextuales y funcionales, trascendiendo la mera predicción estructural. Otra área donde AlphaFold 4 tiene un potencial significativo es en la reducción o eliminación de la dependencia de los alineamientos de secuencias múltiples (MSA). Las MSAs son fundamentales en los modelos actuales para extraer señales evolutivas, pero presentan limitaciones cuando se encuentra con proteínas nuevas o con pocos homólogos conocidos. Investigaciones recientes sugieren que es posible entrenar modelos que, aunque usan solo la secuencia única, logran inferir características evolutivas implícitas, imitando una especie de consulta interna o recuperación de información.
AlphaFold 4 podría avanzar en la combinación eficiente de ambos enfoques, usando información evolutiva cuando esté disponible y ataques más generalizados basados en aprendizaje profundo para secuencias solitarias. En el campo del diseño de proteínas, AlphaFold 4 promete facilitar la ingeniería molecular al permitir una mejor exploración de los paisajes energéticos conformacionales. Actualmente, las técnicas como el diseño asistido por AlphaFold se limitan a escenarios donde el espacio de búsqueda es relativamente simple o bien conocido. La incorporación de técnicas avanzadas de muestreo, como la difusión estocástica o métodos bayesianos, permitirán diseñar proteínas con funciones novedosas, estructuras flexibles o interacciones específicas, incluso en ausencia de datos evolutivos abundantes. Un aspecto social y de acceso también está presente en la discusión sobre AlphaFold 4.
El panorama actual muestra una creciente tendencia hacia desarrollos cerrados y privados, lo que preocupa a la comunidad abierta y académica. AlphaFold 4 podría representar una oportunidad para revitalizar el paradigma abierto mediante estrategias de colaboración, acceso controlado a través de APIs, o iniciativas que permitan a investigadores alrededor del mundo explorar el poder predictivo con una combinación equilibrada entre la propiedad intelectual y el avance científico global. Finalmente, los próximos avances en AlphaFold 4 no solo dependerán de mejoras en la arquitectura modelo o mayor poder computacional, sino también en la calidad, diversidad y cantidad de datos estructurales experimentales. Estudios que permitan captar el plegamiento dinámico de proteínas y sus estados intermedios serán vitales para entrenar modelos que no solo predigan estructuras finales, sino que también simulen caminos de plegamiento o mecanismos moleculares. En resumen, AlphaFold 4 tiene el potencial de ser un modelo multifacético que combina inteligencia artificial con física, bioquímica y biología evolutiva para ofrecer una visión mucho más completa y funcional de las proteínas.
Será un avance esencial para áreas como la biomedicina, la industria farmacéutica, la biotecnología y la ciencia básica. La convergencia de datos, modelado y mayor acceso promete que en los próximos años los misterios que rodean a las proteínas sean cada vez más accesibles para la humanidad.