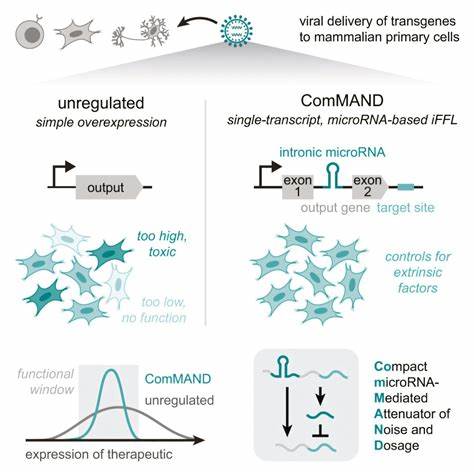
Las enfermedades raras representan un desafío constante para la medicina moderna, debido principalmente a su baja prevalencia y a la complejidad inherente en su tratamiento. Muchas de estas condiciones son causadas por la ausencia o mal funcionamiento de un solo gen, lo que hace que la terapia génica sea una opción prometedora para su tratamiento. Sin embargo, uno de los mayores obstáculos para el éxito de estas terapias ha sido controlar con precisión la cantidad de proteína que se produce al introducir un gen terapéutico en las células del paciente. Un avance reciente desarrollado por investigadores del Instituto de Tecnología de Massachusetts (MIT) propone una solución revolucionaria que podría transformar el enfoque actual de la terapia génica para enfermedades raras. El problema central con muchas terapias génicas radica en el hecho de que la expresión del gen introducido puede variar enormemente de célula en célula.
Esto sucede porque la entrega del gen terapéutico a través de vectores virales no es uniforme: mientras algunas células pueden recibir múltiples copias, otras pocas o ninguna. Esta variabilidad puede resultar en una baja efectividad si la expresión es insuficiente, o en toxicidad si el nivel es excesivo. La necesidad de un sistema que permita un control preciso y estable en la expresión del gen ha sido, hasta ahora, un reto significativo. El equipo de MIT, liderado por la investigadora Katie Galloway y su estudiante Kasey Love, ha desarrollado un circuito genético compacto denominado ComMAND, que utiliza la propia maquinaria celular para autoregular la expresión del gen terapéutico. Este circuito se fundamenta en un mecanismo conocido como circuito de alimentación incoherente hacia adelante (IFFL, por sus siglas en inglés), que incluye el uso de microARN, pequeñas moléculas de ARN que interfieren en la traducción de los genes y, por lo tanto, regulan la cantidad de proteína producida.
La innovación radica en que el microARN regulador está codificado dentro del mismo gen terapéutico, específicamente dentro de un pequeño segmento llamado intrón. Cuando el gen es transcrito en ARN mensajero para producir la proteína terapéutica, simultáneamente se genera el microARN que modera esa producción. Este diseño permite que ambos elementos se expresen en proporciones similares, creando un mecanismo de retroalimentación negativa que mantiene la expresión génica dentro de un rango óptimo. Además, la simplicidad del diseño permite que todo el circuito pueda ser controlado mediante un solo promotor genético, facilitando el ajuste de la expresión al reemplazar este promotor con versiones de diferentes fortalezas. Esto posibilita una personalización precisa del nivel de expresión del gen, crucial para adaptar la terapia a la enfermedad específica y a las características del paciente.
Uno de los aspectos más significativos de esta estrategia es su compatibilidad con los sistemas de entrega viral más comunes en terapia génica, como los lentivirus y los virus adenoasociados (AAV). Su tamaño compacto facilita incluir todo el circuito en un único vector, lo que optimiza la manufactura y potencialmente reduce los costos y complejidades logísticas. Para demostrar la efectividad de ComMAND, los investigadores aplicaron esta tecnología en varios modelos celulares humanos utilizando genes terapéuticos relacionados con enfermedades raras graves. Por ejemplo, trabajaron con el gen FXN, cuya mutación ocasiona la ataxia de Friedreich, una enfermedad neurodegenerativa que afecta el corazón y el sistema nervioso, y con el gen Fmr1, vinculado con el Síndrome de X Frágil, principal causa hereditaria de discapacidad intelectual. Los resultados mostraron que la expresión del gen terapéutico se mantuvo dentro de un rango aproximadamente ocho veces mayor al nivel natural, contrastando con expresiones sin regulación que excedían cincuenta veces el nivel normal, lo que podría generar toxicidad.
Además, se evidenció que el circuito ComMAND logra reducir la variabilidad de expresión entre células, un factor clave para la seguridad y eficacia de las terapias génicas. También se llevaron a cabo estudios en diferentes tipos celulares, incluyendo neuronas de rata, fibroblastos murinos y células T humanas. En estos modelos, el circuito demostró la capacidad de mantener niveles controlados de expresión incluso bajo condiciones de entrega variable de los vectores virales, representando un avance importante hacia aplicaciones clínicas. El impacto potencial de esta tecnología no se limita únicamente a las enfermedades mencionadas. El equipo de MIT señala que podría ser aplicable en otras patologías genéticas raras, tales como el síndrome de Rett, la distrofia muscular y la atrofia muscular espinal, donde es fundamental administrar el gen terapéutico en dosis precisas para evitar efectos adversos y obtener resultados terapéuticos efectivos.
Uno de los desafíos persistentes en el desarrollo de terapias para enfermedades raras es la escasez de pacientes y la limitada inversión financiera, dificultando ensayos clínicos a gran escala y el desarrollo de tratamientos personalizados. La robustez y flexibilidad del circuito ComMAND ofrecen un enfoque que puede ser ajustado y optimizado para diferentes condiciones con relativa rapidez, lo que podría acelerar la disponibilidad de terapias eficaces para estas poblaciones. Los investigadores subrayan que, aunque los resultados preliminares son muy prometedores, se necesitan estudios adicionales en modelos animales y, eventualmente, ensayos clínicos para determinar la eficacia y seguridad definitiva de esta estrategia. La capacidad para modular la expresión genética con precisión también abre la puerta para nuevos desarrollos en medicina personalizada, donde cada paciente podría recibir una terapia ajustada a sus necesidades moleculares específicas. En conclusión, el diseño innovador de circuitos genéticos compactos que utilizan microARN para autorregular la expresión terapéutica representa un avance esencial en la terapia génica para enfermedades raras.
Esta tecnología no solo promete mejorar la seguridad y efectividad de las terapias actuales, sino también facilitar el desarrollo y la manufactura de nuevos tratamientos que puedan cambiar radicalmente el pronóstico de enfermedades que hoy carecen de cura efectiva. A medida que la investigación continúa, el futuro para pacientes con enfermedades genéticas raras parece cada vez más esperanzador gracias a estos emocionantes avances en biología sintética y terapia génica.