La comprensión detallada de la distribución espacial de biomoléculas en tejidos es fundamental para desentrañar los mecanismos fisiológicos y patológicos de los organismos multicelulares. Tradicionalmente, el mapeo molecular ha sido un desafío por las limitaciones técnicas de resolución, sensibilidad y throughput, especialmente cuando se trata de visualizar simultáneamente una amplia gama de biomoléculas, incluyendo lípidos, metabolitos, proteínas y glicanos. En este contexto, TEMI, o Tissue-Expansion Mass-Spectrometry Imaging, emerge como una técnica innovadora capaz de superar estas barreras y ofrecer una perspectiva sin precedentes en el análisis espacial molecular de tejidos. TEMI combina la expansión física del tejido con la potencia de la espectrometría de masas por desorción/ionización asistida por matriz láser (MALDI-MSI), permitiendo que los tejidos se dilaten isotrópicamente para favorecer la resolución espacial sin sacrificar la cantidad de datos o la sensibilidad analítica. A diferencia de otros métodos de expansión que aplican procesos agresivos como digestiones enzimáticas o tratamientos térmicos, TEMI preserva la integridad biomolecular anclando químicamente las proteínas al hidrogel de expansión, manteniendo el estado nativo y asegurando la retención de lípidos, metabolitos y péptidos durante la expansión.
La funcionalidad se basa en un protocolo de múltiples etapas donde tejido fresco o fijado se somete a un tratamiento con un agente cruzante que vincula proteínas al polímero hidrogel que se forma in situ. Esta red tridimensional de gel permite una ampliación lineal hasta casi 3.5 veces mediante re-embedding y expansión en soluciones tampón, logrando una resolución efectiva cercana a la unicelular cuando se combina con el análisis MALDI-MSI. Esta técnica también mantiene la viabilidad para análisis en ambos modos iónicos —positivo y negativo— ampliando así el espectro detectable de moléculas. Una de las ventajas notables de TEMI es su compatibilidad con diversas moléculas.
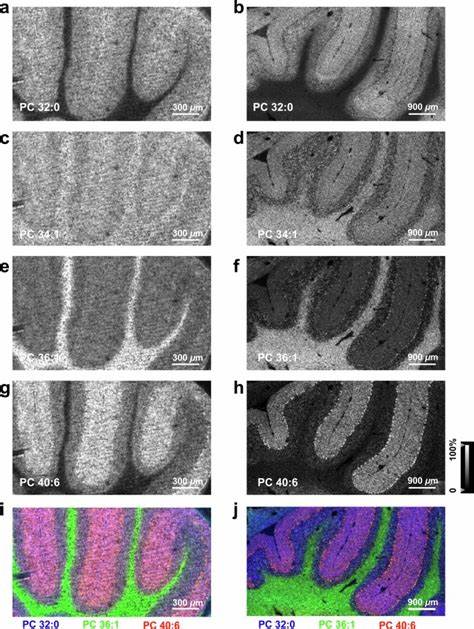
Permite la observación detallada de lípidos como fosfatidilcolinas, que muestran una distribución específica en distintas capas de tejidos cerebrales como el cerebelo. De hecho, utilizando TEMI, se han distinguido con precisión las capas molecular, granular y de materia blanca del cerebelo, identificando firmas lipídicas inéditas asociadas a cada uno de esos compartimientos funcionales. Esto representa un avance sustancial para el estudio neuroquímico y podría tener implicancias en la comprensión de patologías neurológicas. Además de lípidos, TEMI ha demostrado eficacia en la identificación y localización de metabolitos pequeños y glicanos N, ampliando su aplicación para estudios metabolómicos y glicobiológicos espaciales. Por ejemplo, metabolitos relacionados con la señalización y el metabolismo celular, como la colina y los ácidos grasos específicos, exhiben patrones de localización distintos que solo pueden ser revelados con una resolución espacial mejorada como la que ofrece TEMI.
Otra dimensión de esta tecnología es su utilidad para el estudio proteómico en tejidos intactos. mediante digestión in situ con tripsina y análisis MALDI-MSI, TEMI facilita la detección de péptidos proteicos con especificidad espacial, identificando proteínas clave como la proteína básica de mielina y la histona H2B en diferentes regiones cerebelosas. Complementariamente, la integración de inmunohistoquímica basada en anticuerpos con etiquetas fotocleavables y análisis por MALDI reproduce y confirma estas distribuciones proteicas, consolidando la robustez del método. Un campo donde TEMI promete un impacto significativo es en la oncología molecular. Al aplicar la técnica en tejidos tumorales de modelos murinos, se evidenció una heterogeneidad metabólica mucho más compleja en comparación con las técnicas tradicionales sin expansión.
La alta resolución permitió segmentar áreas tumorales en múltiples subregiones metabólicamente distintas, información crucial para comprender la microambiente tumoral, identificar nichos metabólicos especializados y potencialmente orientar estrategias terapéuticas personalizadas. Es relevante destacar que TEMI se adapta a diferentes órganos y tipos de tejido, no solo cerebelos y tumores, sino también riñón, páncreas y probablemente otros órganos y modelos experimentales. La precisión en la expansión y la mínima distorsión tisular aseguran que las observaciones sean fiables y reproducibles, con errores de medición inferiores al 12% incluso tras varias rondas de re-embedding. Desde el punto de vista técnico, TEMI simplifica el equipamiento necesario para alcanzar una resolución unicelular en MSI, contrarrestando las limitaciones de costo y complejidad de nuevos instrumentos ultra-precisos. La compatibilidad con modalidades complementarias a MALDI, como desorción electrospray y ablación láser, amplía su inclusión en diversos laboratorios y proyectos de investigación.
Sin embargo, el método aún tiene desafíos por resolver y oportunidades para optimización. La sensibilidad para detectar moléculas libres pequeñas que no estén ancladas sigue siendo limitada debido a posibles pérdidas durante el proceso de expansión. Además, aumentar la expansión más allá de 3.5 veces puede mejorar aún más la resolución, pero implica disminuir la densidad biomolecular y por ende un potencial descenso en la señal detectada, por lo que equilibrar estos parámetros es clave para futuras mejoras. Las modificaciones químicas en enlaces aminos primarios también pueden afectar ciertos análisis proteicos, por lo que se aconseja evitar tinciones que compitan con estos grupos funcionales cuando el objetivo sea un análisis proteómico detallado.
TEMI representa una convergencia prometedora de técnicas químicas, biológicas y analíticas que amplían la capacidad de cartografiar biomoléculas con un detalle espacial sin precedentes en tejidos intactos. Esta innovación abre puertas para una investigación biomédica más profunda, permitiendo explorar la heterogeneidad molecular a nivel celular y subcelular, comprender procesos fisiológicos complejos, y descubrir biomarcadores y dianas terapéuticas en condiciones como el cáncer, trastornos neurológicos y enfermedades metabólicas. En la era actual de la biología espacial y la multi-ómica, TEMI se posiciona como una técnica imprescindible para científicos que buscan no solo detectar sino contextualizar biomoléculas en su entorno tisular nativo. La combinación de facilidad de implementación, aumento de resolución y preservación de la señal molecular la convierten en una herramienta trascendental para avanzar en la comprensión de la vida a nivel molecular y celular, aportando un nuevo lente para visualizar la complejidad de la salud y la enfermedad.