El cáncer representa una de las principales amenazas para la salud global, con millones de casos diagnosticados cada año y un impacto devastador en la calidad de vida y longevidad de los pacientes. La naturaleza compleja y multifacética de los tumores ha llevado a la investigación científica a explorar vías innovadoras para combatir esta enfermedad, trascendiendo los tratamientos convencionales como la quimioterapia, cirugía y radioterapia. En este contexto, una nueva frontera en la oncología aparece a partir de la comprensión de la interacción metabólica entre las células tumorales y su entorno, particularmente el tejido adiposo. La implantación de adipocitos ingenierizados o modificados genéticamente, que compiten con las células cancerosas por nutrientes esenciales, ha demostrado reducir significativamente la progresión tumoral en diversos modelos de cáncer. Este enfoque, denominado Transplante de Manipulación Adiposa (TMA), explota la capacidad metabólica de los adipocitos para captar y metabolizar glucosa y ácidos grasos, limitando el acceso de los tumores a estos combustibles vitales para su crecimiento.
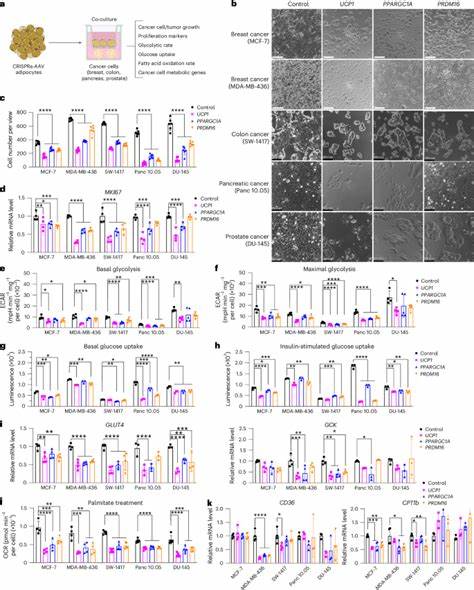
Los adipocitos, o células grasas, poseen una notable plasticidad metabólica. Pueden transformar la energía almacenada en calor a través de un proceso conocido como termogénesis, principalmente mediado por la proteína desacoplante 1 (UCP1). La activación de esta vía induce un aumento robusto en el consumo de glucosa y ácidos grasos, desviando recursos que, hasta ahora, eran aprovechados por las células tumorales para su proliferación y supervivencia. Mediante herramientas modernas como la activación CRISPRa, se puede estimular la expresión de genes clave en adipocitos blancos para inducir su transformación hacia un fenotipo marrón o pardo, caracterizado por un metabolismo energético acelerado. Estudios recientes demuestran que la co-implantación de adipocitos modificados con altos niveles de UCP1 junto a células cancerosas o xenoinjertos en modelos murinos provoca una reducción notable en el tamaño tumoral.
Además, estos adipocitos interferidos disminuyen la angiogénesis y la hipoxia, condiciones que suelen favorecer el avance agresivo del cáncer. En modelos genéticos de cáncer de mama y páncreas, los resultados han sido igualmente prometedores, indicando una supresión significativa de la progresión tumoral. La relevancia clínica de esta técnica se ve reforzada por los resultados obtenidos al utilizar adipocitos derivados de tejido mamario humano, modificados ex vivo mediante CRISPRa. Estos adipocitos pueden inhibir el crecimiento de organoides tumorales derivados de pacientes, tanto en cultivo celular como en xenoinjertos, abriendo la puerta a terapias autólogas personalizadas. Esto representa un avance sustancial, especialmente para pacientes con predisposición genética a cáncer de mama, como aquellas portadoras de mutaciones en BRCA1 o BRCA2.
El mecanismo central detrás de la eficacia de los adipocitos ingenierizados radica en su competencia metabolica. Al aumentar la captación y uso de glucosa y ácidos grasos, estas células limitan el acceso de las células tumorales a estos nutrientes que son vitales para su metabolismo acelerado, especialmente en condiciones de hipoxia y estrés nutricional comúnmente presentes en el microambiente tumoral. Esta competencia no solo reduce la proliferación tumoral, sino que también altera el perfil metabólico del tumor, disminuyendo la expresión de transportadores y enzimas relacionadas con la glicólisis y la oxidación de ácidos grasos. Es relevante destacar que la eficacia de este método puede ser mitigada si se incrementa la disponibilidad de nutrientes, como sucede en modelos animales alimentados con dietas ricas en grasas o glucosa. Esto enfatiza que el éxito de la terapia puede estar condicionado por el contexto metabólico del paciente, invitando a considerar ajustes dietéticos complementarios para maximizar la respuesta terapéutica.
Además, la tecnología TMA no se limita a la manipulación del metabolismo de glucosa y lípidos. Investigaciones avanzadas incluyen la ingeniería de adipocitos para captar y consumir otros metabolitos esenciales para ciertos tumores, como la uridina, en cánceres de páncreas dependientes de esta vía metabólica. La versatilidad de este enfoque ofrece la posibilidad de adaptar el perfil metabólico del adipocito ingerido según las características particulares del tumor, personalizando la terapia en función del tipo y estado del cáncer. Otro aspecto innovador asociado a esta estrategia es el desarrollo de sistemas de regulación inducible del gen UCP1 mediante vectores virales que responden a fármacos como la tetraciclina. Estos sistemas permiten activar o desactivar la función termogénica del adipocito implantado según sea necesario, contribuyendo a un control terapéutico ajustado y limitando posibles efectos adversos, como la caquexia asociada al consumo excesivo de energía corporal.
Asimismo, se están diseñando plataformas que integran los adipocitos modificados en andamios biomateriales que facilitan su implantación, supervivencia y eventual extracción o reemplazo, aumentando la seguridad y practicidad del tratamiento. Esta ingeniería de tejidos aplicada a la implantación celular promete optimizar la integración y funcionalidad de los adipocitos modificados dentro del organismo del paciente. El uso clínico de la implantación de adipocitos ingenierizados se beneficia del hecho de que la extracción y trasplante de tejido adiposo son procedimientos médicos bien establecidos, como ocurre en cirugías reconstructivas después de mastectomías. Esto facilita una rápida transición de esta tecnología desde el laboratorio a la práctica clínica con protocolos que aprovechen liposucción para obtener células adiposas autólogas, que posteriormente pueden ser modificadas y reimplantadas, minimizando riesgos inmunológicos y promoviendo una terapia personalizada. En la discusión más amplia sobre los factores que influyen la progresión tumoral, el tejido adiposo ha sido tradicionalmente asociado con un aumento en el riesgo y agresividad del cáncer, particularmente en pacientes obesos, donde se observa inflamación crónica y alteraciones hormonales.
Sin embargo, la propuesta invertida del uso de adipocitos activados para competir metabólicamente con los tumores redefine el papel del tejido adiposo en oncología, transformándolo en un aliado terapéutico. Este avance invita a repensar las estrategias de tratamiento oncológico integrando la manipulación metabólica del microambiente tumoral. En lugar de atacar directamente al tumor con agentes tóxicos, se pueden diseñar terapias que modifiquen el ecosistema tumoral, restringiendo sustancialmente los recursos metabólicos que sostienen el crecimiento y la invasión. El futuro del tratamiento del cáncer parece inclinarse hacia enfoques combinados en los que la implantación de adipocitos ingenierizados pueda ser complementada con terapias convencionales, inmunoterapias y modificaciones dietéticas. Esta combinación permitirá maximizar la eficacia y reducir los efectos adversos asociados a las terapias actuales.
En conclusión, la implantación de adipocitos modificados genéticamente representa una estrategia revolucionaria en la lucha contra el cáncer, basada en la competencia metabólica directa con las células tumorales. La capacidad para personalizar este enfoque, su compatibilidad con procedimientos médicos ya consolidados y la versatilidad para adaptarse a diferentes tipos de tumores y entornos metabólicos empresan un futuro prometedor para pacientes y clínicos por igual, marcando un hito en la transformación del tratamiento oncológico contemporáneo.