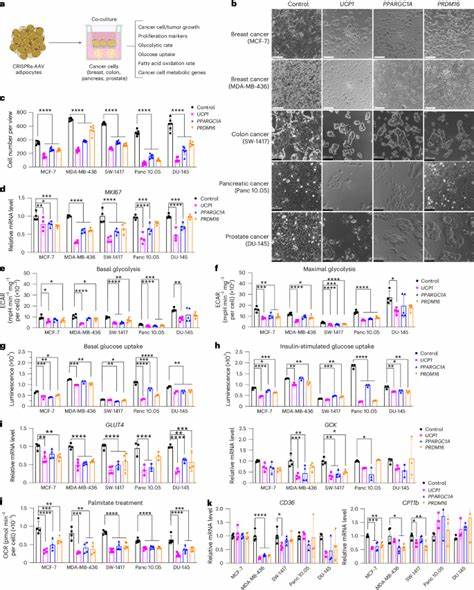
El cáncer continúa siendo una de las principales causas de muerte a nivel mundial, lo que impulsa una constante búsqueda de tratamientos innovadores y efectivos. En este contexto, la implantación de adipocitos modificados genéticamente emerge como una estrategia revolucionaria en la lucha contra la progresión tumoral. Esta técnica aprovecha las capacidades metabólicas de las células adiposas para disminuir el acceso de los tumores a los nutrientes clave indispensables para su crecimiento y supervivencia. Los tumores, debido a su rápido crecimiento, requieren grandes cantidades de energía y materiales metabólicos, fundamentalmente glucosa y ácidos grasos. Para satisfacer esta demanda, las células cancerígenas reprograman su metabolismo, incrementando la captación de glucosa y modificando la oxidación de lípidos, un fenómeno conocido como efecto Warburg.
Esta adaptación metabólica es vital para mantener su proliferación y resistencia en un microambiente caracterizado por hipoxia y limitaciones nutricionales. En respuesta, científicos han desarrollado una tecnología llamada trasplante de manipulación adiposa (AMT) que consiste en la implantación de adipocitos humanos blancos a los que se les induce un proceso de 'pardeamiento' o 'beiging'. Este cambio funcional transforma las células adiposas blancas en un tipo más activo metabólicamente, similar al tejido adiposo marrón, reconocido por su capacidad de disipar energía mediante la termogénesis. La técnica utiliza la activación de genes clave, como UCP1, mediante tecnología CRISPRa, incrementando la capacidad de estas células para consumir glucosa y ácidos grasos. Este aumento en la demanda metabólica de los adipocitos modificados les permite competir directamente contra las células tumorales por los nutrientes disponibles en el microambiente tumoral.
Estudios in vitro revelaron que la co-cultivación de estas células adiposas modificadas con distintos tipos de líneas de cáncer, entre ellos los de mama, colon, páncreas y próstata, redujo significativamente la proliferación tumoral y la expresión de marcadores de crecimiento celular. Además, se observó una reducción notable en parámetros relacionados con la glucólisis y la oxidación de ácidos grasos en las células cancerígenas co-cultivadas. En modelos animales inmunodeprimidos, la co-implantación de adipocitos pardeados junto con células cancerosas generó tumores de menor volumen, con características morfológicas que indicaban menor proliferación, hipoxia y angiogénesis. Estas observaciones sugieren que el AMT no solo afecta la proliferación tumoral sino también reduce factores relacionados con la progresión y la agresividad del cáncer. Una particularidad importante del AMT es la versatilidad para su personalización según el tipo de tumor.
Por ejemplo, en el caso del cáncer pancreático ductal, se demostró que la sobreexpresión de la enzima uridina fosforilasa 1 (UPP1) en adipocitos permitió competir con el tumor por la uridina, un nutriente alternativo necesario para su metabolismo, logrando así inhibir la progresión tumoral. Este hallazgo abre la puerta a potenciar el AMT para atacar distintas rutas metabólicas específicas de diferentes tumores. El trasplante de adipocitos modificados también ha sido validado en modelos genéticos de cáncer de páncreas y mama, demostrando una eficacia significativa para reducir el desarrollo tumoral. En modelos de mama donde se implantaron adipocitos pardeados tanto cerca como a distancia del tumor, se observó un efecto supresor similar, lo que revela un posible mecanismo sistémico mediado por la competencia de nutrientes y mejora metabólica del organismo. Otro aspecto relevante es la disminución observada en los niveles plasmáticos de insulina en los animales tratados con adipocitos pardeados.
Dado que la insulina es un factor de crecimiento conocido para varios tipos de cáncer, esta reducción podría contribuir adicionalmente a la supresión tumoral, vinculando por primera vez modificaciones en el metabolismo sistémico promovidas por el AMT con la regulación del crecimiento tumoral. Las técnicas de implantación se han optimizado para garantizar viabilidad, funcionalidad y control de los adipocitos. El desarrollo de sistemas inducibles mediante el uso de tetraciclina permite activar o desactivar la expresión de los genes clave, brindando seguridad y flexibilidad clínica. Asimismo, la integración de estos organoides adiposos en dispositivos de soporte biomaterial que facilitan su transporte y retiro representa un avance hacia aplicaciones terapéuticas controladas y reversibles. La viabilidad clínica y la aplicabilidad del AMT se apoyan en la facilidad que existe para la extracción del tejido adiposo de los pacientes, como ocurre en procedimientos rutinarios de liposucción.
Los adipocitos del propio paciente pueden ser modificados ex vivo y posteriormente reimplantados, minimizando riesgos de rechazo inmunológico. En particular, en pacientes con cáncer de mama que requieren cirugía reconstructiva, esta técnica podría integrarse en el proceso quirúrgico para maximizar beneficios oncológicos y estéticos. Además, el AMT también muestra potencial para la prevención en personas con predisposición genética al cáncer, como aquellas portadoras de mutaciones en los genes BRCA1, BRCA2 y RAD51D. En ensayos co-cultivados, adipocitos pardeados lograron inhibir la proliferación y reducir marcadores asociados con fenotipos premalignos en organoides derivados de tejido mamario no canceroso de estos individuos, lo que plantea posibilidades en estrategias de intervención temprana. El trasplante de adipocitos modificados también presenta ventajas frente a terapias convencionales.
Al funcionar mediante competencia metabólica, no depende de mecanismos inmunológicos o genotóxicos directos, lo que podría traducirse en menor toxicidad y efectos secundarios. También ofrece la flexibilidad de combinaciones con tratamientos como quimioterapia, radioterapia o inmunoterapia, potenciando la efectividad global. Sin embargo, existen desafíos por superar para la implementación clínicamente estándar del AMT. Es necesario optimizar la cantidad y el tipo de adipocitos implantados, garantizar que no se promueva el síndrome de caquexia asociado a la activación excesiva de la termogénesis y desarrollar protocolos robustos para la manipulación, almacenamiento y entrega segura. En el futuro, el AMT podría expandirse para incorporar células modificadas para la secreción de agentes terapéuticos, incluyendo proteínas antitumorales o moduladores del sistema inmune, aumentando así la capacidad del tejido adiposo implantado para combatir el cáncer desde múltiples frentes.
La hoja de ruta se complementaría con la mejora de plataformas de entrega celular inteligentes, que respondan dinámicamente a cambios en el microambiente tumoral. En resumen, la implantación de adipocitos genéticamente modificados para incrementar su actividad metabólica y competencia por nutrientes representa un avance prometedor en la oncología moderna. La tecnología AMT combina la biología celular, la genética y la ingeniería biomédica para ofrecer un enfoque innovador que minimiza el metabolismo tumoral y limita su progresión. Con continuas investigaciones, esta estrategia podría convertirse en parte fundamental del arsenal terapéutico contra el cáncer, mejorando los resultados clínicos y la calidad de vida de los pacientes.