El cáncer representa uno de los mayores desafíos para la salud global, dada su complejidad biológica y su capacidad para adaptarse y evadir múltiples tratamientos convencionales. Ante este panorama, la ciencia ha buscado nuevas estrategias para abordar su crecimiento y progresión, explorando vías innovadoras que van más allá de las terapias tradicionales. En este contexto, la implantación de adipocitos modificados genéticamente emerge como una alternativa prometedora para suprimir el desarrollo tumoral mediante la competencia metabólica directa con las células cancerosas. Los adipocitos, o células grasas, desempeñan un papel esencial en la regulación del metabolismo energético del organismo. Particularmente, el tejido adiposo marrón (BAT) es conocido por su capacidad para consumir grandes cantidades de glucosa y ácidos grasos para producir calor a través de un proceso denominado termogénesis no temblorosa, mediado principalmente por la proteína desacoplante 1 (UCP1).
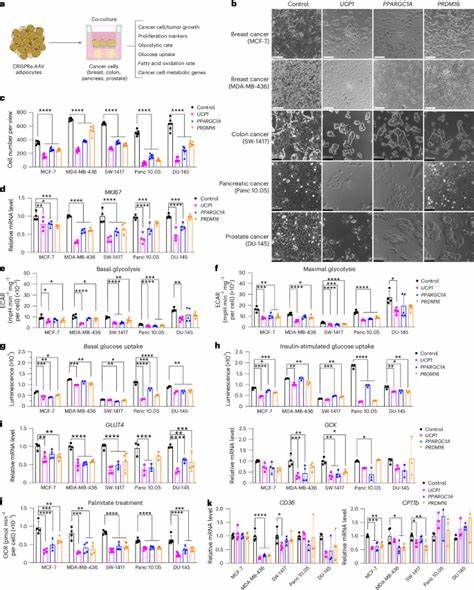
Aprovechando este concepto, un equipo de científicos ha desarrollado una técnica denominada Trasplante de Manipulación Adiposa (AMT), que consiste en implantar adipocitos ingenierizados para aumentar su consumo energético, compitiendo directamente con los tumores por los nutrientes esenciales que requieren para su crecimiento acelerado. Utilizando herramientas moleculares avanzadas como la activación CRISPR (CRISPRa), los investigadores lograron incrementar selectivamente la expresión de genes clave como UCP1, PPARGC1A y PRDM16 en adipocitos humanos diferenciados. Esta manipulación genética induce un fenotipo similar al tejido adiposo marrón en las células grasas, aumentando notablemente su capacidad para captar glucosa y metabolizar ácidos grasos. Estos adipocitos modificados se cultivaron en organoides tridimensionales que reflejaban mejor la arquitectura y función natural del tejido adiposo, y posteriormente se implantaron en diversos modelos murinos de cáncer, incluyendo tumores de mama, páncreas, colon y próstata. Los resultados de estos estudios fueron contundentes.
Los tumores que coexistían con adipocitos modificados presentaron una reducción significativa en su tamaño y proliferación celular, evidenciada por una disminución de marcadores como Ki67 y MKI67. Además, se observó una reducción en la angiogénesis y en las zonas de hipoxia dentro del microambiente tumoral, lo cual suele estar asociado con un pronóstico más desfavorable. Este efecto supresor fue atribuido a que los adipocitos modificados consumían grandes cantidades de glucosa y ácidos grasos, privando a las células tumorales de los recursos necesarios para su metabolismo y crecimiento. La competencia metabólica entre adipocitos y células cancerosas afecta principalmente dos vías críticas: la glucólisis, responsable de la descomposición rápida de glucosa para generar energía, y la oxidación de ácidos grasos, la cual provee una fuente energética altamente eficiente. Al reducir la disponibilidad de éstos, las células cancerosas ven comprometido su metabolismo adaptativo, reduciendo así su capacidad proliferativa.
Esta estrategia clínica resulta innovadora porque no ataca directamente al tumor, sino que modifica el microambiente para hacerlo menos favorable para la expansión tumoral. Un aspecto fundamental de esta técnica es su potencial reversibilidad y control. Mediante la incorporación de sistemas inducibles, como los activados por tetraciclina, es posible regular la expresión de los genes modificados en los adipocitos, permitiendo activar o desactivar la competencia metabólica según las necesidades terapéuticas o la respuesta del paciente. Adicionalmente, se desarrollaron plataformas de entrega con dispositivos scaffolds poliméricos biocompatibles que albergan los organoides adiposos, facilitando la implantación y extracción de estos tejidos modificados de manera segura y eficiente. Este enfoque no se limita únicamente a la competencia por glucosa y ácidos grasos.
En el caso del cáncer de páncreas, que presenta una dependencia particular por nucleósidos como la uridina, la modulación genética de adipocitos para aumentar la expresión de uridina fosforilasa 1 (UPP1) demostró también su capacidad para privar a las células tumorales de este nutriente esencial, inhibiendo su crecimiento. Esto subraya la versatilidad de la AMT para adaptarse a diferentes perfiles metabólicos tumorales, ofreciendo una estrategia personalizada y ajustada al tipo de cáncer y su microambiente. En modelos preclínicos de cáncer de mama y páncreas, la implantación de adipocitos modificados no sólo redujo el tamaño de los tumores sino que también mejoró parámetros sistémicos como la sensibilidad a la insulina y la tolerancia a la glucosa, indicando beneficios metabólicos añadidos para el organismo del paciente. Estos aspectos son especialmente relevantes dado el vínculo estrecho entre la obesidad, disfunción metabólica e incidencia de diversos tipos de cáncer. Desde una perspectiva clínica, la AMT presenta múltiples ventajas.
La obtención de adipocitos autólogos a través de liposucción es un procedimiento común y seguro en la práctica médica, lo que facilita la recolección del material celular para su modificación ex vivo. Posteriormente, los adipocitos pueden ser manipulados genéticamente y expandirse en cultivos tridimensionales antes de ser reimplantados en el paciente, ya sea cerca del tumor o en un sitio distal para ejercer un efecto sistémico. Esta terapia celular tiene el potencial de evitar efectos secundarios asociados a tratamientos más agresivos, al no involucrar directamente compuestos tóxicos o radiación. No obstante, como toda innovación terapéutica, existen retos que superar. Uno de ellos es la posible asociación con la caquexia cancerosa, un síndrome de desgaste corporal en el que el tejido adiposo y muscular se ven afectados.
Hasta el momento, en los modelos experimentales utilizados no se observó pérdida significativa de peso ni otros signos de caquexia, pero se requieren estudios prolongados para garantizar la seguridad en aplicaciones clínicas. Además, la capacidad de controlar la actividad metabólica de los adipocitos implantados mediante reguladores farmacológicos o dispositivos de liberación aumenta la seguridad del procedimiento, permitiendo detener la terapia en caso de efectos adversos e individualizando el tratamiento conforme a la evolución del paciente. La integración de estos enfoques con terapias convencionales, como la quimioterapia o la inmunoterapia, podría potenciar significativamente la eficacia y ofrecer nuevas esperanzas para pacientes con cáncer refractario o avanzado. Por último, la capacidad de modificar adipocitos para adaptarse a diferentes perfiles metabólicos de tumores abre un horizonte hacia terapias personalizadas y multifactoriales. Esta versatilidad permitirá atacar distintos cánceres con variados requerimientos nutricionales, haciendo de la competencial metabólica un frente complejo para la supervivencia tumoral.
En conclusión, la implantación de adipocitos ingenierizados para competir por nutrientes esenciales demuestra ser una estrategia innovadora y efectiva para suprimir el crecimiento tumoral en modelos preclínicos de cáncer. Este enfoque basado en la manipulación del microambiente metabólico ofrece una nueva perspectiva en el tratamiento oncológico, con potencial para ser adaptado y combinado con otras modalidades terapéuticas. A medida que avancen las investigaciones clínicas, la AMT podría convertirse en una herramienta fundamental para mejorar la supervivencia y calidad de vida de pacientes con cáncer en el futuro cercano.