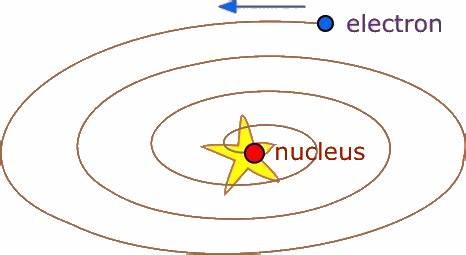
La estructura atómica ha sido una fuente constante de fascinación y estudio en la física y la química durante más de un siglo. Un cuestionamiento básico pero profundo que surge en el estudio del átomo es: ¿por qué los electrones no caen en el núcleo? Al observar el modelo clásico del átomo, desde una perspectiva intuitiva, parecería lógico que un electrón, que es una partícula cargada negativamente, se sienta atraído por el núcleo positivo y termine colapsando dentro de él, similar a cómo la gravedad hace que un satélite caiga hacia la Tierra si pierde velocidad. Sin embargo, esto no sucede y esta aparente paradoja tiene sus raíces en las leyes fundamentales que rigen el mundo subatómico. Para comprenderlo, es necesario desglosar tanto la visión clásica como los avances revolucionarios introducidos por la mecánica cuántica. Desde un punto de vista clásico, un electrón en órbita alrededor del núcleo sería similar a un planeta girando alrededor del sol.
Las fuerzas en juego seguirían una ley inversa al cuadrado de la distancia, tal como lo establece la fuerza gravitacional o la fuerza electrostática de Coulomb. La fuerza atractiva entre el núcleo, con carga positiva, y el electrón, con carga negativa, ejerce una influencia hacia el centro. Sin embargo, el electrón en movimiento debería emitir radiación electromagnética debido a su aceleración constante al cambiar de dirección, perdiendo energía poco a poco. Este fenómeno, conocido desde el siglo XIX, implica que el electrón perdería su energía cinética gradualmente, espiralando hacia el núcleo y causando el colapso del átomo. Un escenario que, por supuesto, no se observa; los átomos son estables y la materia no se desintegra espontáneamente bajo estas condiciones.
¿Qué falla entonces en el modelo clásico? La gran excepción es que las partículas subatómicas no se comportan como objetos clásicos definidos y localizados con precisión, sino que exhiben propiedades duales de onda y partícula. Este concepto, conocido como dualidad onda-partícula, es la clave para resolver la contradicción. En el mundo cuántico, un electrón no es una simple partícula que se mueve en una órbita fija, sino una entidad cuyas propiedades se describen mejor mediante probabilidades y funciones de onda. La ubicación exacta y la velocidad simultáneamente son conceptos imprecisos para estas partículas diminutas, según el principio de incertidumbre formulado por Werner Heisenberg. Esta relación establece que cuanto más precisamente tratemos de medir la posición del electrón, menos conoceremos su momento, y viceversa.
Al adoptar la descripción cuántica, el electrón en el átomo de hidrógeno, por ejemplo, se representa mediante una función de onda que describe una nube de probabilidad donde es más probable encontrarlo. Dentro de esta nube, la probabilidad es más alta cerca del núcleo, pero no en un punto determinado, de modo que la posición del electrón está «difusa». De esta manera, el electrón no se encuentra orbitando el núcleo en la forma clásica, sino más bien formando un patrón estacionario de probabilidad llamado orbital. El modelo cuántico también introduce la idea de que la energía del electrón está cuantizada, es decir, solo ciertos valores discretos de energía están permitidos. Cuando un electrón ocupa el estado de menor energía posible, o estado fundamental, su energía total es estable y no puede disminuir espontáneamente.
Esto evita que el electrón libere energía para caer al núcleo, porque hacerlo implicaría un cambio prohibido en su estado energético. La estabilidad del estado fundamental es lo que garantiza que el electrón permanezca en su «región orbital» sin hundirse en el núcleo. Otra forma de entender la estabilidad del átomo es considerar la competencia entre la energía potencial y la energía cinética del electrón. Conforme el electrón se acerca al núcleo, su energía potencial electrostática se vuelve más negativa (más atractiva). Sin embargo, debido a la naturaleza de la mecánica cuántica y el confinamiento espacial, limitar la posición del electrón a una región muy pequeña implica que su energía cinética aumenta debido a la incertidumbre en su momento.
Esta batalla de fuerzas opuestas evita que el electrón colapse en el núcleo y crea un equilibrio; el electrón «baila» a una distancia promedio que corresponde a lo que se conoce como el radio de Bohr en el hidrógeno. Si bien es común interpretar que la mayor densidad de probabilidad del electrón está cerca del núcleo, es crucial distinguir entre la densidad de probabilidad en un punto dado y la probabilidad radial, que considera una esfera completa alrededor del núcleo. La probabilidad radial permite comprender que la máxima probabilidad de encontrar al electrón se halla no en el centro exacto del núcleo, sino a una distancia específica, reforzando la idea del radio de Bohr como la posición orbital más probable. Los avances en la teoría atómica y los modelos mecánico-cuánticos han cambiado radicalmente nuestra percepción de la naturaleza de la materia y el comportamiento de sus componentes. Por ejemplo, la idea de que el electrón es un «wavicle», un híbrido entre onda y partícula, propuesto en tono algo humorístico por Arthur Eddington, encapsula esta compleja realidad que desafía la intuición clásica.