En el campo de la neuropsiquiatría, el desarrollo de tratamientos efectivos y seguros representa un desafío persistente, especialmente en enfermedades complejas como la esquizofrenia y la depresión. Históricamente, los antipsicóticos se han centrado en la modulación del sistema dopaminérgico para controlar los síntomas psicóticos, pero estos tratamientos a menudo vienen acompañados de efectos secundarios significativos, como trastornos motores o disfunciones metabólicas, y suelen ser menos efectivos contra los síntomas negativos y cognitivos del trastorno. En este contexto, surge un avance revolucionario gracias a la creación de un nuevo análogo del LSD llamado (+)-JRT, un compuesto diseñado racionalmente que exhibe una acción antipsicótica sin depender del sistema dopaminérgico, lo que abre una puerta hacia terapias más seguras y efectivas. El LSD tradicional es conocido por su potente acción sobre los receptores serotoninérgicos, especialmente en el receptor 5-HT2A, modulando la neuroplasticidad cortical y mostrando un gran potencial terapéutico. Sin embargo, su uso clínico está limitado por sus propiedades alucinógenas y su contraindicación en pacientes con antecedentes o predisposición a trastornos psicóticos, como la esquizofrenia.
La novedad principal del compuesto (+)-JRT es su capacidad para preservar los efectos terapéuticos del LSD, como la promoción del crecimiento neuronal y la mejora en la conectividad sin inhibir la funcionalidad cognitiva ni inducir alucinaciones. Desde un punto de vista molecular, (+)-JRT es un isómero constitucional del LSD, en el que se han transpuesto solamente dos átomos, creando así un cambio estructural sutil pero con impactos funcionales profundos. Esta modificación evita la formación de un enlace de hidrógeno crucial entre el LSD y ciertas regiones del receptor 5-HT2A (específicamente con los residuos S2425.46 o G2385.42), lo que altera la cinética y el patrón de activación del receptor, resultando en un ligando parcial que activa la señalización Gq sin promover la vía de reclutamiento de β-arrestina 2, asociada con los efectos psicodélicos.
Esta característica particular se traduce en una reducción significativa del potencial alucinógeno de (+)-JRT, validado mediante ensayos en modelos animales, como el test de respuesta de movimiento de cabeza (HTR) en ratones, una medida preclínica altamente correlacionada con efectos psicodélicos en humanos. Asimismo, (+)-JRT no exacerba ni induce déficits en la inhibición prepulso (PPI), lo que indica que no promueve ni acentúa síntomas psicóticos asociados a los trastornos de la corteza prefrontal y al sistema dopaminérgico. En contraposición, el compuesto podría ofrecer un perfil antipsicótico favorable al no ejercer afinidad ni bloqueo sobre receptores dopaminérgicos D2, evitando así los efectos adversos comunes vinculados a dicha interacción. Un aspecto destacado del mecanismo de acción de (+)-JRT es su selectividad altamente afinada hacia ciertos receptores serotoninérgicos, actuando como agonista parcial en 5-HT2A y 5-HT2C, y antagonista en 5-HT5A y 5-HT7. Entre estos, la agonización de 5-HT2C es particularmente relevante, ya que se ha demostrado que este receptor modula la liberación de dopamina en áreas como el núcleo accumbens, contribuyendo a regular los estados de hiperactividad dopaminérgica que suelen estar alterados en trastornos psicóticos.
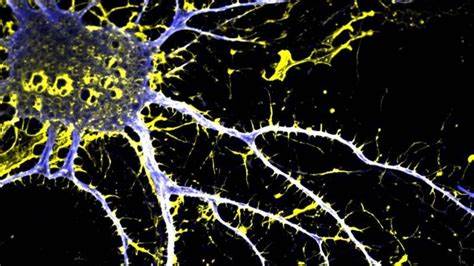
La activación del 5-HT2C puede, por tanto, ayudar a compensar desbalances neuroquímicos sin la necesidad de interrumpir directamente la transmisión dopaminérgica, un enfoque innovador para el tratamiento de la esquizofrenia y trastornos relacionados. Más allá de la acción farmacológica, (+)-JRT presenta un claro efecto neuroplástico, promoviendo la dendritogénesis y el aumento de densidad de espinas dendríticas en neuronas corticales tanto in vitro como in vivo. Estudios con microscopía electrónica de secciones seriadas del córtex prefrontal medial en modelos murinos demostraron que una única dosis de (+)-JRT incrementa la densidad sináptica y de espinas dendríticas, respaldando su potencial para corregir los déficits estructurales de sinapsis y morfología neuronal vinculados a la patología de diversas enfermedades psiquiátricas. Estas propiedades neuroplásticas también se manifestaron en la capacidad del compuesto para revertir la atrofia cortical inducida por estrés crónico mediante administración de corticosterona, un modelo de estrés que reproduce aspectos de anhedonia y disfunción cognitiva presentes en la esquizofrenia y la depresión. La restauración de la densidad de espinas en neuronas corticales confirma la utilidad de (+)-JRT no solo como agente sintomático sino también como modulador estructural capaz de mejorar la plasticidad neuronal y facilitar la recuperación funcional.
En el plano conductual, el análogo mostró efectos terapéuticos extendidos en modelos relevantes, como ensayos de conducta de desesperanza aprendida y pruebas de preferencia por sacarosa para evaluar anhedonia, característicos de los síntomas negativos y depresivos en la esquizofrenia. Los resultados fueron contundentes, con dosis mínimas que produjeron mejorías rápidas y sostenidas en el comportamiento, superando incluso a ketamina, otro agente psicoplastógeno conocido. Además, el compuesto mejoró significativamente la flexibilidad cognitiva en modelos de estrés inducido, evaluada a través de tareas de discriminación y reversión. Estas mejoras tienen especial relevancia clínica debido a que el deterioro cognitivo es un componente esencial y difícil de tratar en los trastornos psiquiátricos. Desde la perspectiva de seguridad y efectos secundarios, (+)-JRT no mostró signos de toxicidad, tampoco indujo estrés serotoninérgico ni efectos motores adversos en los animales estudiados.
Tampoco produjo activación indeseada de genes asociados a la esquizofrenia en la corteza prefrontal, en contraste con los cambios de expresión inducidos por dosis similares de LSD clásico. Esta diferencia es crucial para su potencial aplicación clínica, ya que sugiere un perfil más seguro y menos propenso a exacerbar o inducir síntomas psicóticos. El desarrollo de (+)-JRT fue posible gracias a un enfoque de diseño molecular racional basado en la transposición atómica dentro del ergolino, lo que permitió conservar las interacciones clave dentro del bolsillo de unión del receptor 5-HT2A mientras se eliminaba la capacidad de formar un enlace de hidrógeno responsable del efecto alucinógeno. La síntesis total de (+)-JRT requirió un proceso de 12 pasos, que incluyó reacciones como acoplamiento Suzuki y modificaciones regioselectivas. La precisión en la síntesis fue validada posteriormente mediante cristalografía de rayos X, confirmando la estructura y configuración absolutas equivalentes al LSD pero con la modificación deseada.
Este análogo también representa la expansión de una nueva clase de psicoplastógenos no alucinógenos derivados de estructuras psicodélicas tradicionales, un área de investigación creciente que busca maximizar el beneficio terapéutico de estos compuestos mientras se minimizan o eliminan sus efectos secundarios indeseados. Estudios previos han mostrado que otros análogos no alucinógenos pueden promover plasticidad neuronal y efectos antidepresivos, pero el perfil único de (+)-JRT lo posiciona como un candidato prometedor para tratar un rango más amplio de síntomas psiquiátricos, incluidos los negativos y cognitivos, junto con la seguridad que permite su uso en poblaciones vulnerables. En conclusión, el análogo del LSD denominado (+)-JRT representa un avance significativo en la farmacoterapia de trastornos neuropsiquiátricos complejos. Su mecanismo de acción no dopaminérgico, su potente efecto neuroplástico y su bajo perfil alucinógeno ofrecen una alternativa a los modelos terapéuticos actuales, centrados principalmente en la dopamina y con limitaciones en su efectividad y tolerabilidad. Los resultados en modelos animales anticipan que (+)-JRT podría ofrecer beneficios terapéuticos para pacientes con esquizofrenia, depresión resistente y otros trastornos relacionados, sin los efectos secundarios devastadores que a menudo limitan la adherencia y la calidad de vida.
El futuro de este desarrollo requiere ensayos clínicos para verificar su seguridad, farmacocinética y eficacia en humanos, así como estudios profundizados en los mecanismos moleculares involucrados. Sin embargo, esta innovación abre la puerta a una nueva generación de tratamientos psicodélicos diseñados con precisión que pueden transformar el abordaje mundial de las enfermedades mentales debilitantes.