El cáncer sigue siendo una de las principales causas de mortalidad a nivel global, y a pesar de los avances en tratamientos convencionales como la cirugía, la quimioterapia y la radioterapia, la búsqueda de terapias innovadoras y efectivas continúa siendo prioritaria. En este contexto, una estrategia emergente y prometedora es la implantación de adipocitos modificados para frenar el crecimiento tumoral mediante la competencia metabólica, un enfoque que explota las propiedades naturales del tejido adiposo para alterar el microambiente tumoral y limitar la disponibilidad de nutrientes esenciales para las células cancerosas. Los tumores se caracterizan por su rápida proliferación y alta demanda energética, lo que los obliga a adaptarse y reprogramar su metabolismo para optimizar el uso de nutrientes como la glucosa y los ácidos grasos. La conocida ‘efecto Warburg’ explica cómo las células cancerosas prefieren la glucólisis aeróbica, incluso en presencia de oxígeno, para satisfacer sus necesidades metabólicas. Además, en condiciones de hipoxia, estas células también aumentan su dependencia de la oxidación de ácidos grasos, que genera el doble de energía por molécula comparado con la glucosa.
Esta adaptabilidad metabólica se convierte en una vulnerabilidad que puede ser explotada mediante terapias dirigidas a limitar la disponibilidad de estos nutrientes. En este marco, la implantación de adipocitos diseñados para ser metabólicamente activos y competir eficazmente por glucosa y ácidos grasos frente a las células tumorales se presenta como una alternativa innovadora. Estos adipocitos, sometidos a una modificación genética que induce la expresión de proteínas clave como la UCP1 (proteína desacoplante 1), aumentan su capacidad para captar y metabolizar estos nutrientes, creando un entorno de competencia que restringe la provisión de energía a las células cancerosas, ralentizando su proliferación y progresión. La tecnología denominada “Transplante de Manipulación Adiposa” (AMT, por sus siglas en inglés) utiliza la capacidad natural del tejido adiposo blanco para convertirse en un tejido beige o marrón, fenómeno conocido como “browning” o “beiging”. Mediante la activación genética dirigida por CRISPRa, se logra la sobreexpresión de genes relacionados con el metabolismo energético, como UCP1, PPARGC1A y PRDM16, que promueven un aumento significativo en la captación de glucosa y ácidos grasos y en la tasa de consumo de oxígeno.
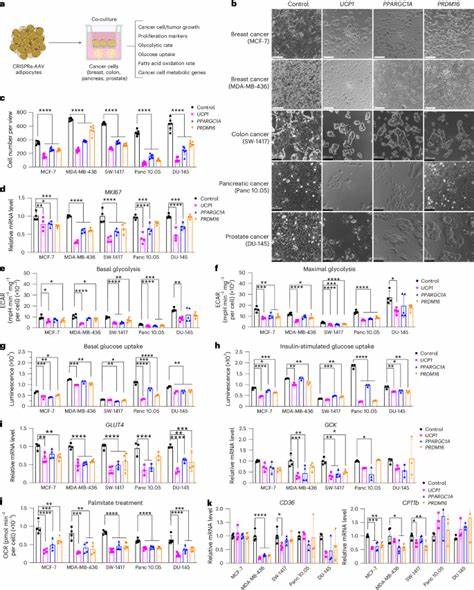
Experimentos in vitro utilizando co-cultivos de adipocitos modificados con células tumorales han demostrado una reducción notable en la proliferación de diversos tipos de cáncer, incluyendo cáncer de mama, colon, páncreas y próstata. Estas células cancerosas co-cultivadas presentan una menor expresión de marcadores proliferativos, así como una disminución en la actividad de la glucólisis y la oxidación de ácidos grasos, evidenciada mediante pruebas de tasa de consumo de oxígeno y captación de glucosa. En modelos animales inmunodeficientes, la co-implantación de organoides adiposos modificados junto con líneas celulares tumorales genera una reducción significativa en el tamaño tumoral. Este efecto se relaciona no sólo con la limitación de nutrientes sino también con un menor estrés hipóxico, disminución de angiogénesis y una mayor apoptosis celular en los tumores. Sorprendentemente, la implantación de estos adipocitos modificados en sitios distales al tumor también logra resultados similares, lo que sugiere un efecto sistemático de competición metabólica y regulación hormonal.
De hecho, los estudios han documentado que los ratones con adipocitos modificados para expresar UCP1 presentaban mayor consumo total de oxígeno, mejor tolerancia a la glucosa y sensibilidad a la insulina, junto con niveles plasmáticos de insulina más bajos. Estas condiciones fisiológicas contribuyen a una reducción directa en los factores de crecimiento y supervivencia que usualmente promueven la progresión tumoral. Así, la implantación de adipocitos “browneados” no sólo impacta ambientalmente a nivel local sino también influye en el metabolismo sistémico. Además, la flexibilidad de AMT permite la personalización de la terapia. Por ejemplo, la regulación inducible mediante tetraciclinas posibilita el control reversible de la expresión de genes clave, ajustando la actividad metabólica de los adipocitos implantados según la necesidad clínica y evitando así posibles efectos adversos como la caquexia asociada al cáncer.
De igual manera, el desarrollo de plataformas integradas de scaffolds biodegradables para la entrega de estos organoides adiposos optimiza la integración tisular y facilita la extracción o reemplazo si es necesario. Aún más, AMT se puede adaptar para combatir distintos perfiles metabólicos tumorales. En neoplasias pancreáticas que dependen fuertemente de la uridina, la sobreexpresión de la enzima uridina fosforilasa 1 (UPP1) en adipocitos permite competir por dicha molécula, reduciendo su disponibilidad para las células cancerosas y limitando así su crecimiento. Esto demuestra la capacidad de esta terapia para ajustarse a características metabólicas específicas de cada tumor, ampliando su espectro de acción. La oportunidad clínica que ofrece AMT es considerable, particularmente al considerar la facilidad y rutina de la extracción y trasplante de tejido adiposo en cirugía reconstructiva y estética.
La posibilidad de obtener adipocitos del propio paciente mediante liposucción o durante procedimientos quirúrgicos, seguido de su modificación ex vivo y posterior reimplantación, abre la puerta a tratamientos personalizados con menor riesgo de rechazo inmunológico. Este enfoque es especialmente relevante en cáncer de mama, donde la reconstrucción post-mastectomía puede combinarse con la implantación de adipocitos modificados para permitir terapias combinadas de soporte y tratamiento. Pese a sus prometedores resultados, AMT plantea retos y áreas de investigación. La seguridad de la modificación genética mediante CRISPRa requiere continuidad en los estudios para evaluar su efecto a largo plazo y minimizar riesgos fuera del objetivo. Asimismo, la regulación metabólica y la posible inducción de cachexia deben ser monitoreadas detalladamente para garantizar un perfil de seguridad adecuado.
La optimización de la dosis celular y la frecuencia de implantación también son variables críticas a definir. Por otro lado, la interacción entre adipocitos y células tumorales es compleja y multifacética. Además del consumo competitivo de nutrientes, los adipocitos pueden secretar adipocinas y factores bioactivos que modulan la respuesta inmune, la angiogénesis y la degradación de la matriz extracelular, influenciando potencialmente el microambiente tumoral de distintas formas. Estudios futuros deberán dilucidar estas interacciones para maximizar el efecto terapéutico y evitar posibles contribuciones pro-tumorales. En conclusión, la implantación de adipocitos genéticamente modificados para competir por nutrientes esenciales frente a células cancerosas representa una innovación terapéutica con un enorme potencial para transformar el tratamiento del cáncer.
Esta estrategia de manipulación metabólica abre un nuevo paradigma donde la terapia celular no solo busca eliminar las células tumorales directamente, sino crear un entorno hostil a su crecimiento mediante la redistribución y competencia por recursos bioquímicos fundamentales. Su aplicabilidad en múltiples tipos de cáncer, la posibilidad de ajuste personalizado y su integración en protocolos clínicos existentes hacen de AMT un enfoque que merece la atención puntual e inversión en esfuerzos de investigación clínica para avanzar hacia su desarrollo y validación en humanos.