El cáncer continúa siendo una de las enfermedades más desafiantes y mortales a nivel mundial, con millones de casos nuevos y muertes cada año. A pesar de los avances en cirugía, quimioterapia, radioterapia e inmunoterapia, la necesidad de nuevas estrategias terapéuticas sigue siendo imperiosa. Un área emergente que genera gran expectación se enfoca en el sistema metabólico tumoral y su interacción con el microambiente. En este contexto, surge una innovadora aproximación basada en la implantación de adipocitos modificados genéticamente para competir con las células cancerosas por los nutrientes esenciales que necesitan para crecer y proliferar, ofreciendo un nuevo paradigma en el tratamiento del cáncer. El tumor no es simplemente un conjunto homogéneo de células cancerosas sino un entorno complejo y dinámico donde coexisten diferentes tipos celulares, como células del sistema inmune, fibroblastos, células endoteliales y adipocitos, junto con una matriz extracelular que contribuye a la supervivencia y propagación tumoral.
A nivel metabólico, las células tumorales exhiben una capacidad notable para reprogramar diversas rutas metabólicas, adaptándose a un microambiente hipóxico y carente de nutrientes, lo que les permite sostener su rápido crecimiento y resistir las barreras naturales del organismo. Uno de los rasgos metabólicos más característicos del cáncer es el efecto Warburg, que implica una elevada captación y metabolismo de glucosa mediante glicólisis aeróbica, lo que genera energía rápidamente, aún en presencia de oxígeno. Además, muchas células tumorales incrementan el uso de ácidos grasos como fuente energética, especialmente en condiciones de hipoxia, explotando así la potencialidad metabólica disponible dentro del microambiente tumoral. Por ello, la manipulación del metabolismo tumoral surge como una táctica terapéutica atractiva. Estratégicamente, se han desarrollado fármacos dirigidos a bloquear rutas clave, tales como la inhibición de hexoquinasa 2 en glicólisis o el bloqueo de transportadores de glucosa GLUT1 y GLUT4.
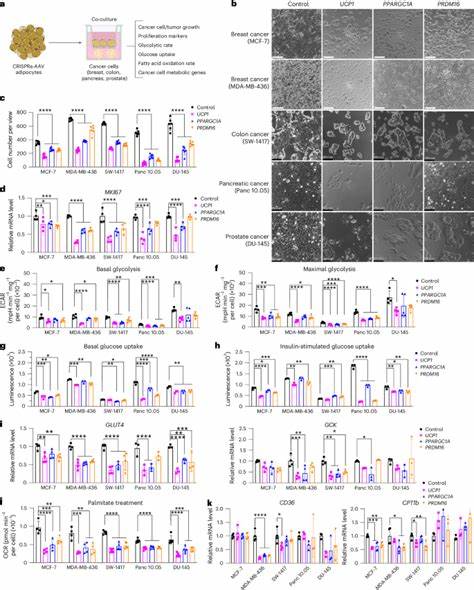
Así mismo, han surgido compuestos que interrumpen la captación y metabolismo de lípidos, atacando proteínas transportadoras y enzimas lipogénicas. No obstante, a pesar de estos avances, los resultados clínicos aún no son conclusivos y persisten retos relacionados con la toxicidad y selectividad. En este escenario, el concepto de implantación de adipocitos ingenierizados para competir metabólicamente con las células tumorales, denominado trasplante por manipulación adiposa (AMT, por sus siglas en inglés), ofrece una alternativa revolucionaria. Los adipocitos, células especializadas en almacenar y metabolizar lípidos, poseen una notable plasticidad metabólica y pueden ser reprogramados para aumentar su consumo de glucosa y ácidos grasos, limitando así el acceso de estos nutrientes al tumor. Mediante técnicas avanzadas de activación génica como CRISPRa, es posible aumentar la expresión de genes clave asociados a la función del tejido adiposo marrón, como UCP1, PRDM16 y PPARGC1A, responsables de promover la conversión del tejido adiposo blanco en un fenotipo marrón o beige.
Este fenotipo se caracteriza por una mayor capacidad para la termogénesis no temblorosa y un incremento en el consumo energético, lo que se traduce en un consumo elevado de glucosa y ácidos grasos. Por tanto, los adipocitos modificados, dotados de estas características, pueden implantar-se adyacentes a los tumores o incluso en un sitio distal para desplazar metabolitos críticos y obstaculizar la progresión tumoral. En estudios preclínicos realizados en modelos genéticos y xenoinjertos de cáncer de mama, páncreas, colon y próstata, la coimplantación de adipocitos y organoides adiposos modificados con CRISPRa resultó en una reducción significativa en el tamaño tumoral. Se observó además una disminución en marcadores de proliferación celular como Ki67, así como un descenso en la hipoxia tumoral y la angiogénesis, factores que contribuyen al crecimiento y posible metastatización del tumor. Un hallazgo relevante es que la capacidad de los adipocitos modificados para suprimir el tumor está relacionada con la competencia por nutrientes.
El aumento en el consumo de glucosa y ácidos grasos por parte de estos adipocitos reduce la disponibilidad de estos sustratos en el microambiente tumoral, disminuyendo la capacidad metabólica de las células cancerosas para proliferar y sobrevivir. Interesantemente, en escenarios de elevada disponibilidad de nutrientes, como en dietas altas en grasas o glucosa, esta supresión disminuye, reafirmando la importancia de la competencia metabólica directa. La utilidad de esta estrategia también se ha demostrado utilizando células adiposas extraídas directamente de tejidos humanos, especialmente de tejido mamario, que al ser modificado para aumentar la expresión de UCP1 mediante CRISPRa, logró frenar el crecimiento de organoides tumorales derivados de pacientes con cáncer de mama, incluyendo aquellos con mutaciones de alto riesgo como BRCA1/2. Por otro lado, la implantación de adipocitos modificados no solamente afecta localmente al tumor sino que también produce beneficios a nivel sistémico en los modelos animales estudiados. Se ha evidenciado una mayor sensibilidad a la insulina, mejor tolerancia a la glucosa y una reducción en los niveles plasmáticos de insulina, un factor conocido por promover el crecimiento tumoral a través de su acción mitogénica.
Esto sugiere que la manipulación adiposa puede ejercer un efecto metabólico integral, que contribuye a un ambiente menos propicio para la proliferación tumoral. La versatilidad de la AMT se amplía con sistemas inducibles que permiten la regulación temporal de la activación génica en adipocitos, así como con plataformas de implantación basadas en andamiajes o scaffolds biodegradables que facilitan la distribución, integración y eventual extracción de los adipocitos modificados según el avance o necesidad terapéutica. Esto permite un control fino del tratamiento y la posibilidad de ajustar la intervención a lo largo del curso clínico. Más allá del uso del gen UCP1, otros genes metabólicos pueden ser modulados para atacar rutas metabólicas específicas de diferentes tipos de cáncer. Por ejemplo, la sobreexpresión de uridina fosforilasa 1 (UPP1) en adipocitos ha demostrado ser efectiva en la competencia por uridina en cánceres pancreáticos dependientes de esta ruta metabólica, evidenciando el potencial de personalización y adaptabilidad de esta estrategia.
La implantación de adipocitos modificados para suprimir la progresión tumoral representa una convergencia entre ingeniería genética, biología celular, y medicina traslacional. Gracias a procedimientos clínicos establecidos como la liposucción y la cirugía reconstructiva, resulta factible extraer células adiposas del propio paciente, modificarlas ex vivo para potenciar sus propiedades metabólicas y reimplantarlas, constituyendo una terapia autóloga que minimiza riesgos inmunológicos. No obstante, es fundamental considerar desafíos relacionados con la seguridad y el control de la terapia, especialmente para evitar efectos adversos como la caquexia asociada a tumores o desequilibrios metabólicos. Por ello, la arquitectura de sistemas inducibles y dispositivos implantables reversibles es una innovación crítica para el desarrollo clínico responsable de esta estrategia. En términos de futuro, la integración de esta aproximación con otras modalidades terapéuticas del cáncer podría potenciar la eficacia, al combinar la competencia metabólica con quimioterapia, inmunoterapia, y terapias dirigidas.
Además, la exploración de secreciones terapéuticas derivadas de adipocitos o la manipulación para liberar factores anticancerígenos ofrece nuevas vías para expandir y complementar la AMT. En conclusión, la implantación de adipocitos ingenierizados y modificados metabólicamente abre nuevas perspectivas en el tratamiento oncológico. Al limitar el acceso del tumor a nutrientes clave mediante competencia metabólica activa, esta estrategia novedosa puede frenar la progresión tumoral y ofrecer un enfoque terapéutico personalizado, seguro y adaptable para diversos tipos de cáncer. Se espera que esta línea de investigación continúe avanzando hacia ensayos clínicos y aplicaciones médicas, revolucionando la forma en que se aborda la terapia contra el cáncer en el futuro próximo.



![The inarguably best rhythm [video]](/images/2AB0965A-0635-4E28-A74C-56779D658ED4)




