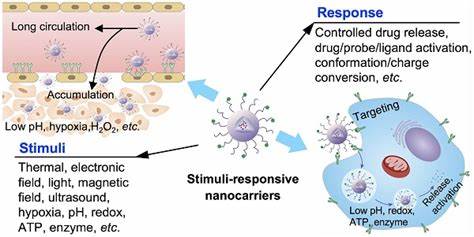
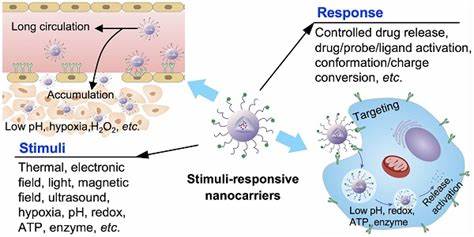
Las infecciones bacterianas crónicas representan uno de los desafíos médicos más complejos debido a la dificultad que supone erradicar las bacterias cuando estas forman biopelículas. Estas estructuras multicelulares, protegidas por una matriz extracelular viscosa llamada matriz de polisacáridos extracelulares (EPS), confieren protección a las bacterias contra los antimicrobianos tradicionales y el sistema inmunológico del cuerpo, lo que resulta en una resistencia incrementada y en infecciones persistentes, especialmente en entornos hospitalarios y pacientes con sistemas inmunológicos comprometidos. En este contexto, surge una innovadora estrategia que combina la administración de antimicrobianos con sistemas activados por ultrasonido, ofreciendo una solución prometedora para superar las barreras físicas y biológicas de las biopelículas. La formación de biopelículas es un mecanismo natural de defensa bacteriana que se establece en superficies tanto biológicas como inertes. Dentro de esta comunidad organizada, las bacterias adoptan diferentes estados metabólicos, incluyendo células activas y células en estado de latencia o 'persister', las cuales son particularmente difíciles de eliminar.
La matriz EPS no solo limita la penetración de fármacos, sino que también actúa como un reservorio de enzimas que degradan antimicrobianos, además de facilitar la comunicación celular que regulan mecanismos de resistencia. En consecuencia, los tratamientos antimicrobianos convencionales requieren elevadas dosis y tiempos prolongados, generando efectos secundarios indeseados y favoreciendo la aparición de resistencia bacteriana. La nanotecnología ha abierto nuevas vías para mejorar el transporte y liberación dirigida de fármacos a través del desarrollo de sistemas de administración a escala nanométrica que pueden encapsular antimicrobianos y liberarlos en sitios específicos con control temporal y espacial. Entre estos sistemas, destacan las nanoemulsiones y nanodroplets recubiertas con fosfolípidos que actúan como vehículos protectores y portadores de medicamentos. Sin embargo, la principal limitación radica en la dificultad de desencadenar la liberación controlada del antimicrobiano exactamente cuando y donde se requiere para maximizar su eficacia contra las células incrustadas dentro de las biopelículas.
Para abordar este problema, los sistemas activados por ultrasonido terapéutico han cobrado gran interés. Estas tecnologías emplean ondas ultrasónicas focalizadas para inducir fenómenos físicos como la cavitación acústica, que consiste en la formación y oscilación controlada de burbujas microscópicas que pueden alterar la estructura física de la biopelícula y mejorar la permeabilidad del fármaco. Cuando los antimicrobianos se encapsulan en nanodroplets sensibles a la activación por ultrasonido, al aplicar la onda ultrasónica, estas partículas experimentan un cambio de fase que genera microburbujas, provocando la ruptura parcial o total de la matriz EPS y facilitando la liberación puntual del medicamento directamente en el interior del biofilm. Una de las ventajas claves de este abordaje multidisciplinar es la reducción drástica en las concentraciones antimicrobianas necesarias para alcanzar niveles terapéuticos efectivos. Por ejemplo, estudios han demostrado que al combinar nanodroplets cargados con agentes antibacterianos como azitromicina, besifloxacina, polimixina B o complejos de rutenio con ultrasonido focalizado, se consigue reducir hasta 40 veces las dosis necesarias para eliminar tanto bacterias planctónicas como las incrustadas en biopelículas, incluyendo las difíciles células persister.
Estas reducciones impactan directamente en la disminución de toxicidad sistémica y en la mitigación del desarrollo de resistencias. Desde el punto de vista molecular, la encapsulación en nanodroplets favorece la protección del antimicrobiano frente a degradación prematura y optimiza su distribución subcelular. Las investigaciones mediante espectrometría de masas con plasma acoplado inductivamente han revelado que la entrega mediante estos nanosistemas mejora la acumulación intracelular del medicamento en las bacterias, especialmente en las membranas y el citoplasma, donde actúan la mayoría de estos fármacos. El ultrasonido, además de generar la ruptura física de la matriz, podría inducir poración temporal en las membranas bacterianas, facilitando la entrada de los agentes antimicrobianos y potencializando su actividad. Además, la capacidad del ultrasonido para inducir la dispersión de células dentro de las biopelículas plantea un desafío: la posibilidad de que estas células liberadas causen nuevas infecciones secundarias o se diseminen.
Sin embargo, la activación simultánea de antimicrobianos ofrece un efecto sinérgico que elimina no solo las células adheridas sino también a las dispersadas, previniendo la re-colonización y las infecciones recurrentes. Esto representa una ventaja crítica en el manejo clínico de infecciones crónicas como las de heridas, vías urinarias, prótesis articulares y enfermedades pulmonares como la fibrosis quística. Esta tecnología posee un gran potencial para la adaptabilidad clínica debido a que utiliza agentes antimicrobianos ya aprobados y dispositivos ultrasónicos comerciales que pueden ser implementados rápidamente en entornos hospitalarios. La fabricación de nanodroplets a partir de agentes de contraste clinicamente aprobados asegura biocompatibilidad y seguridad, facilitando su transición del laboratorio a la práctica médica. Por otro lado, la modularidad del sistema permite la inclusión futura de nuevos compuestos antimicrobianos, enzimas que degraden la matriz biofilm o compuestos gaseosos bioactivos, ampliando el rango terapéutico y optimizando la eficacia.