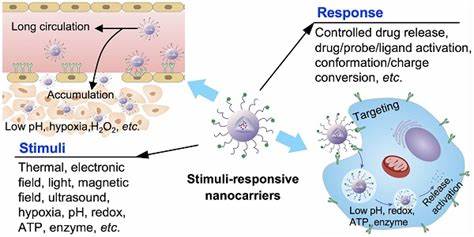
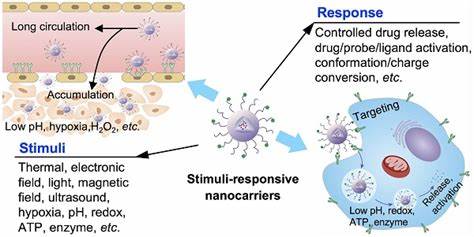
Las infecciones crónicas y nosocomiales continúan representando un desafío significativo en la medicina moderna debido a la resiliencia y resistencia que manifiestan las bacterias cuando forman biofilms. Estos biofilms, estructuras complejas y dinámicas compuestas por comunidades bacterianas que se adhieren a superficies y quedan protegidas bajo una matriz exopolisacárida, ofrecen un refugio que dificulta el acceso y acción efectiva de los antimicrobianos tradicionales. Esta protección no solo disminuye la permeabilidad química de los antibióticos, sino que también favorece la presencia de células bacterianas en estados metabólicos reducidos o dormantes, conocidas como persister cells, que contribuyen a la duración y recurrencia de las infecciones incluso después de tratamientos prolongados y agresivos. En respuesta a estos retos, la comunidad científica ha concentrado esfuerzos en desarrollar sistemas de liberación dirigidos y controlados que incrementen la penetración de fármacos dentro de estos biofilms, mejorando así la eficacia antimicrobiana y reduciendo la necesidad de intervenciones invasivas o regímenes antibióticos de alta dosis que pueden conducir a efectos secundarios adversos y al aumento de resistencias. Una de las estrategias más prometedoras que han emergido en los últimos años es la utilización de plataformas nanoscale activables mediante ultrasonido terapéutico para la entrega dirigida de antimicrobianos.
Los nanodroplets, o nanogotas formadas a partir de agentes de contraste clínicos modificados, ofrecen una interesante solución debido a su tamaño reducido (aproximadamente entre 125 y 250 nanómetros) y su capacidad para ser activados por ultrasonido focalizado. Esta activación desencadena la vaporización de las nanogotas formando microburbujas volátiles que inducen la disrupción mecánica del biofilm a través de efectos de cavitación acústica, facilitando a su vez la liberación localizada de la carga antimicrobiana directamente en el sitio de infección. Diversos antimicrobianos con distintos mecanismos de acción han sido incorporados en estos nanodroplets, incluyendo complejos metálicos de ruthenio, macrólidos como la azitromicina, fluoroquinolonas como la besifloxacina y péptidos antimicrobianos como la polimixina B. Además de proteger al fármaco durante su transporte y mejorar su estabilidad, estos sistemas han demostrado un efecto protector inicial que eleva las concentraciones necesarias para el efecto bactericida en bacterias libres de biofilm, un fenómeno esperado dada la encapsulación. Sin embargo, tras la aplicación de ultrasonido terapéutico, se registró una notable potenciación en la actividad antimicrobiana, llegando a reducir en órdenes de magnitud las concentraciones de antibiótico necesarias para alcanzar mínimos bactericidas y concentraciones capaces de erradicar biofilms completos y células persister.
Los estudios in vitro con cepas clínicas resistentes de Staphylococcus aureus (incluyendo MRSA) y Escherichia coli (con fenotipos ESBL) revelaron que la combinación de antimicrobianos con nanodroplets activados por ultrasonido ofrece una reducción significativa en la concentración eficaz, donde por ejemplo con azitromicina se observaron decrecimientos superiores a 40 veces en las dosis requeridas para eliminar biofilms en comparación con la administración de fármaco libre. Esta disminución en la dosis necesaria no solo refleja un ahorro terapéutico sino que también implica una menor toxicidad potencial y un menor riesgo de inducción de resistencias. El mecanismo detrás de esta mejora radica en la capacidad de las microburbujas generadas por el ultrasonido para alterar la matriz del biofilm mediante la cavitación, facilitando la permeabilidad y distribución del antimicrobiano. Además, el análisis subcelular mediante espectrometría de masas con plasma acoplado inductivamente evidenció que estos sistemas nanoscale incrementan notablemente la acumulación del fármaco dentro de las bacterias alojadas en el biofilm, con una mayor presencia en las membranas bacterianas y en el citoplasma en comparación con la administración convencional. Esta distribución más eficiente dentro de la célula bacteriana amplifica la eficacia antimicrobiana.
Asimismo, el ultrasonido por sí solo no demostró actividad antimicrobiana directa, aunque sí evidenció la capacidad de inducir la dispersión del biofilm, liberando células bacterianas hacia el entorno, lo que en otros contextos podría aumentar el riesgo de diseminación infecciosa. Sin embargo, gracias al efecto combinado del sistema con nanodroplets cargados con antibióticos, las células dispersas y las restantes adheridas fueron prácticamente eliminadas, abordando un problema importante que asociaban las terapias basadas únicamente en la dispersión mecánica. La versatilidad de esta plataforma se ha corroborado en modelos que simulan diversos entornos clínicos, incluyendo biofilms asociados con infecciones en articulaciones protésicas, vejiga urinaria, heridas crónicas y fibrosis quística, mostrando consistentemente la capacidad del método para mejorar significativamente la eliminación bacteriana en condiciones representativas de la complejidad fisiopatológica humana. Este sistema no solo representa una innovación tecnológica sino que también cuenta con una traducción clínica potencial facilitada por el hecho de que utiliza agentes de contraste aprobados y ultrasonido focalizado que ya tienen presencia en el ámbito hospitalario para diagnóstico y terapéutica, acelerando así su posible adopción médica. De cara al futuro, estas plataformas activables por ultrasonido ofrecen la promesa de adaptarse para la liberación de una amplia gama de agentes terapéuticos más allá de los antimicrobianos convencionales, como enzimas capaces de degradar la matriz del biofilm o gases bioactivos, permitiendo una estrategia multifactorial para combatir infecciones resistentes y prevenir la recurrencia.