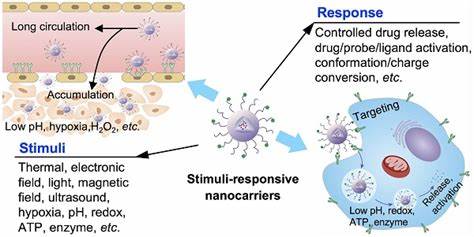
Las infecciones crónicas constituyen uno de los desafíos más complejos en la medicina moderna, en gran parte debido a la presencia persistente de biofilms bacterianos. Estos biofilms son comunidades microbianas organizadas, protegidas por una matriz extracelular, que confieren a las bacterias una resistencia significativamente mayor frente a los tratamientos antimicrobianos convencionales. La dificultad para penetrar eficazmente esta barrera biológica ha impulsado la búsqueda de estrategias innovadoras que superen las limitaciones actuales. En este contexto, los sistemas de entrega de fármacos activados por ultrasonido han emergido como una prometedora alternativa para mejorar la eficacia contra estas infecciones difíciles de tratar. Los biofilms se forman cuando las bacterias se adhieren a superficies y comienzan a secretar una matriz de polisacáridos, proteínas y ADN extracelular llamada matriz extracelular polimérica (EPS).
Esta capa protectora no solo actúa como una barrera física contra los agentes antimicrobianos, sino que también permite la existencia de células bacterianas en estado durmiente o metabólicamente inactivas, conocidas como células persister. Estas formas celulares son más resistentes a los antibióticos y pueden reactivar la infección incluso después de tratamientos prolongados. Por ello, erradicar completamente los biofilms requiere superar múltiples obstáculos: penetración, desintegración del EPS y eliminación de las células persister. Los métodos antimicrobianos tradicionales suelen ser ineficaces para alcanzar concentraciones terapéuticas dentro del biofilm debido a la limitada difusión y la actividad reducida contra las bacterias en estados metabólicos bajos. Esto ha llevado, con frecuencia, a tratamientos prolongados con dosis altas o incluso a intervenciones quirúrgicas invasivas, ambas con riesgos considerables para los pacientes.
Por lo tanto, la necesidad de sistemas que puedan administrar de manera eficaz y localizada los antimicrobianos a través de la matriz biofilm y activen simultáneamente mecanismos disruptivos ha sembrado el terreno para las tecnologías basadas en ultrasonido y nanoportadores. Los nanosistemas responden a estímulos externos ofreciendo una liberación controlada y localizada del fármaco. En particular, los nanodroplets son partículas lipídicas revestidas que contienen un núcleo de perfluorocarbono líquido a temperatura corporal. Cuando son expuestos a un ultrasonido terapéutico de frecuencia específica, estos nanodroplets experimentan un cambio de fase que provoca su vaporización en microburbujas. Este proceso genera un fenómeno conocido como cavitación acústica, que induce efectos mecánicos que pueden desestabilizar y dispersar la matriz biofilm, facilitando al mismo tiempo la liberación y penetración del agente antimicrobiano directamente en las bacterias incrustadas.
Este enfoque multifuncional ofrece una doble ventaja: primero, la destrucción física parcial del biofilm crea canales y reduce la protección intrínseca que confiere; segundo, la liberación local y controlada del fármaco aumenta su concentración intracelular, mejorando así la capacidad bactericida sin exponer al paciente a dosis sistémicas elevadas. Estudios recientes han demostrado que al cargar antimicrobianos con diferentes mecanismos de acción en estos nanodroplets, como azitromicina, besifloxacino, polimixina B y complejos de ruthenio, y combinar esta administración con ultrasonido focalizado, se consigue una reducción significativa en las concentraciones necesarias para alcanzar niveles bactericidas mínimos, tanto en bacterias en suspensión (planktonicas) como en células dentro de biofilms. El desarrollo de estos nanodroplets requiere un equilibrio cuidadoso en cuanto a tamaño, estabilidad y capacidad de carga. Generalmente, el tamaño hidrodinámico oscila entre 125 y 250 nanómetros, lo que permite una mejor interacción y penetración dentro del biofilm comparado con las microburbujas tradicionales mucho mayores. La estabilidad en su concentración y tamaño es crítica para asegurar la reproducibilidad y la eficacia terapéutica, manteniéndose intactos durante períodos prolongados en condiciones corporales simuladas.
Asimismo, la cantidad de antimicrobiano incorporado debe maximizar su carga pero sin comprometer la integridad estructural ni la respuesta al ultrasonido. La caracterización de estos sistemas implica diversos métodos que incluyen interferometría, dispersión de luz dinámica y mediciones eléctricas para determinar distribución de tamaños y concentración, complementadas con técnicas de alto rendimiento para validar la composición química y la liberación del fármaco. La activación por ultrasonido se realiza frecuentemente a frecuencias en torno a 3 MHz con presiones acústicas calibradas para inducir vaporación y cavitación sin daños colaterales excesivos en tejidos circundantes. Desde el punto de vista microbiológico, las pruebas in vitro con cepas clínicas resistentes, tanto Gram-positivas (como S. aureus resistente a meticilina) como Gram-negativas (E.
coli productoras de beta-lactamasas de espectro extendido - ESBL), evidencian que la encapsulación de antimicrobianos en nanodroplets confiere inicialmente un efecto protector que eleva las concentraciones mínimas inhibidoras. Sin embargo, la aplicación del ultrasonido en conjunto revierte esta protección y reduce dramáticamente los niveles de antimicrobianos necesarios para obtención de efectos bactericidas, erradicación del biofilm y eliminación de células persister. En algunos casos, la reducción necesaria puede ser de hasta 40 veces comparado con el uso del fármaco libre. La mejora en la penetración se atribuye a la combinación de mecanismos físicos y bioquímicos: la cavitación rompe los enlaces de la matriz EPS y promueve la convección intracavitacional, mientras que la liberación localizada y la posible formación de poros en la membrana bacteriana facilitan la internalización del fármaco. Las técnicas analíticas avanzadas, como la espectrometría de masas con plasma acoplado inductivamente (ICP-MS), han revelado incrementos en la acumulación intracelular del agente antimicrobiano cuando se administra a través de nanodroplets bajo ultrasonido, con un aumento significativo sobre todo en fracciones citoplasmáticas y membranas celulares, que son los sitios principales de acción antimicrobiana.
Esto tiene especial relevancia en el tratamiento de infecciones asociadas a biofilms en condiciones clínicas difíciles, como en heridas crónicas, infecciones urinarias, enfermedades pulmonares como la fibrosis quística, y prótesis infectadas. Simulaciones en medios artificiales que reprodujeron estos entornos permitieron validar que la tecnología ND/FUS (nanodroplets combinados con ultrasonido focalizado) puede dispersar biofilms establecidos y eliminar microorganismos resistentes, disminuyendo la presencia de células persister y evitando potenciales recaídas infecciosas. Un aspecto destacado es la capacidad del ultrasonido no solo para dispersar el biofilm sino también para “reactivar” estados celulares durmientes, haciendo a las bacterias más susceptibles a los antimicrobianos liberados. Al reactivar estas células persister, los tratamientos combinados evitan la difícil erradicación de estos reservorios de infección. De esta forma, el método elimina tanto las bacterias activas como aquellas que podrían generar una reinfección futura.
Los beneficios clínicos esperados incluyen una reducción de los tiempos y dosis terapéuticas necesarias, minimización de efectos secundarios sistémicos y un menor riesgo de desarrollo de resistencia, dado que el antimicrobiano se libera en concentraciones localizadas y en momentos precisos. Además, la utilización de agentes antimicrobianos ya aprobados y plataformas basadas en contrastes ecográficos comerciales ofrece un camino acelerado hacia la aplicación clínica, evitando largos y costosos procesos regulatorios asociados al desarrollo de nuevos fármacos. No obstante, todavía existen retos en el camino hacia la implementación clínica. Es necesario definir con precisión los parámetros del ultrasonido que maximicen la eficacia sin dañar tejidos vecinos, asegurar la reproducibilidad y escalabilidad de la fabricación de nanodroplets, y validar la seguridad y biocompatibilidad a largo plazo en modelos animales y humanos. Asimismo, la heterogeneidad de biofilms en diferentes pacientes y condiciones clínicas puede requerir la personalización del tratamiento.
El futuro de esta tecnología podría incluir la incorporación de múltiples agentes antimicrobianos en un solo sistema, la combinación con enzimas degradadoras de matriz o moduladores de señalización bacteriana para potenciar la destrucción del biofilm, y la integración con sistemas de diagnóstico por imagen para monitorizar en tiempo real la liberación y efecto del tratamiento. En resumen, los sistemas antimicrobianos encapsulados en nanodroplets activados por ultrasonido representan un avance significativo que podría revolucionar el manejo de infecciones crónicas asociadas a biofilms. Esta estrategia innovadora ofrece soluciones a los problemas de penetración y resistencia bacteriana, abre nuevas vías terapéuticas y tiene el potencial de mejorar de forma notable los resultados clínicos, la calidad de vida de los pacientes y la sostenibilidad del uso de antimicrobianos en medicina.