El cáncer sigue siendo una de las principales causas de morbilidad y mortalidad a nivel mundial, representando un desafío constante para la ciencia y la medicina. Los tumores malignos no solo se caracterizan por su rápido crecimiento y agresividad, sino también por su capacidad única para adaptarse y explotar los recursos del organismo para su beneficio. En este sentido, la competencia por nutrientes en el microambiente tumoral se ha convertido en un área crítica de investigación que busca identificar nuevas estrategias para limitar la progresión del cáncer. Recientemente, un equipo de investigadores pioneros ha desarrollado un método revolucionario que utiliza la implantación de adipocitos (células grasas) modificados para arrebatar nutrientes a las células tumorales, ralentizando así su crecimiento y expansión. Esta técnica, llamada trasplante de manipulación adiposa (AMT, por sus siglas en inglés), se fundamenta en la ingeniería genética para transformar las propiedades metabólicas de los adipocitos blancos, activándolos para consumir de manera acelerada glucosa y ácidos grasos, recursos vitales para el metabolismo tumoral.
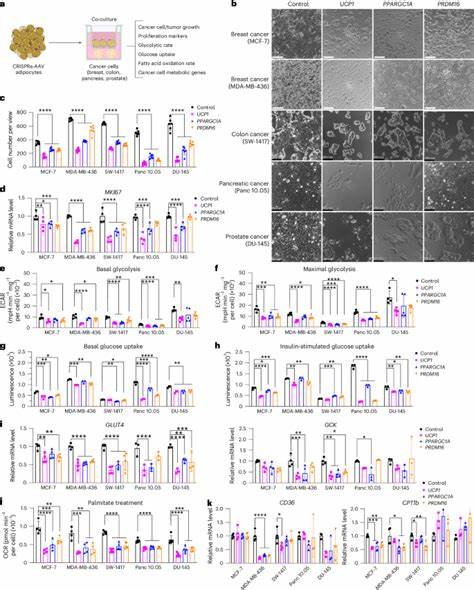
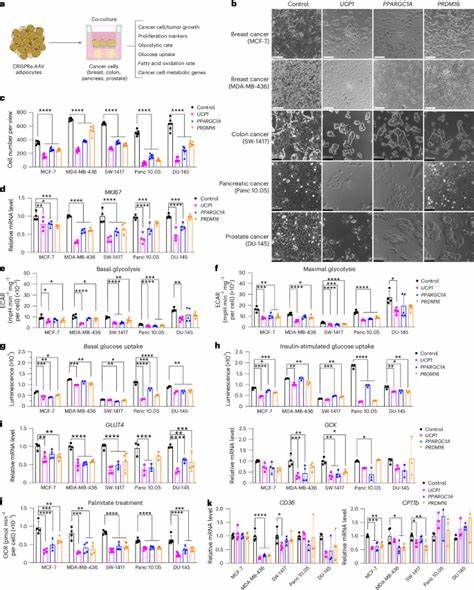
Una de las claves de esta innovación es la modulación de la proteína desacoplante 1 (UCP1), un componente esencial del tejido adiposo marrón, conocido por su función en la generación de calor mediante la disipación de energía. Los adipocitos blancos, que normalmente almacenan grasa, pueden ser inducidos a un estado similar al tejido adiposo marrón, denominado 'beiging' o 'browning', por la expresión aumentada de genes reguladores como UCP1, PPARGC1A y PRDM16. Mediante el uso de tecnologías avanzadas como CRISPR activador (CRISPRa), los científicos han logrado potenciar la expresión de estos genes, creando adipocitos con una elevada demanda metabólica que compiten eficazmente con las células cancerosas por los nutrientes. El metabolismo energético de las células cancerosas se basa predominantemente en la glicólisis aeróbica, conocida como efecto Warburg, donde la glucosa es convertida rápidamente en lactato aun en presencia de oxígeno. Asimismo, en condiciones de hipoxia o escasez de glucosa, las células tumorales adaptan su consumo hacia ácidos grasos, que ofrecen una mayor densidad energética.
Este mecanismo adaptativo contribuye a la agresividad tumoral y a la resistencia frente a tratamientos convencionales. Por lo tanto, reducir la disponibilidad de estos nutrientes puede comprometer la viabilidad y proliferación de las células malignas. Los estudios in vitro han demostrado que la co-cultivación de adipocitos 'marrones' (browning) con diversas líneas celulares de cáncer, como mamario, pancreático, colónico y prostático, resulta en una disminución significativa de la proliferación tumoral. Las células adiposas modificadas disminuyen la captación de glucosa y la oxidación de ácidos grasos en las células cancerosas, lo que conlleva a una reducción del metabolismo glicolítico y lipídico, procesos fundamentales para la generación de energía y biosíntesis en tumores. Por otra parte, las investigaciones en modelos animales inmunodeficientes han confirmado la eficacia terapéutica del AMT.
La co-implantación de organoides adiposos modificados junto a xenoinjertos tumorales induce un control notable del volumen tumoral, acompañado de una reducción en la angiogénesis y la hipoxia tumoral. Estos hallazgos sugieren un ambiente microambiental menos favorable para la progresión neoplásica. Un dato relevante es que esta supresión tumoral no depende exclusivamente de la proximidad física, ya que la implantación a distancia también mostró efectos beneficiosos, lo que abre la posibilidad de aplicaciones clínicas menos invasivas. Además, los organoides adiposos manipulados contribuyen a mejorar la homeostasis metabólica del organismo huésped, aumentando el consumo de oxígeno y mejorando la sensibilidad a la insulina, lo que puede ser favorable para pacientes con cáncer y comorbilidades metabólicas asociadas. Al disminuir los niveles plasmáticos de insulina, una hormona con efectos mitogénicos, estos implantes contribuyen indirectamente a limitar estímulos proliferativos sobre las células tumorales.
Un aporte innovador de la investigación fue la personalización del tratamiento para diferentes tipos de tumores. Por ejemplo, en el caso del adenocarcinoma ductal pancreático, que utiliza uridina como fuente alternativa de energía en entornos con restricción glucídica, se incrementó la expresión de la enzima uridina fosforilasa 1 (UPP1) en los adipocitos, promoviendo la competencia por esta vía metabólica específica y logrando también una reducción significativa del crecimiento tumoral. A nivel clínico, el AMT presenta ventajas importantes, ya que las células adiposas pueden ser obtenidas directamente del paciente mediante métodos sencillos como la liposucción, minimizando los riesgos de rechazo inmune. La manipulación genética ex vivo con CRISPRa permite un control preciso y la posibilidad de activar los genes objetivo de forma inducible, mediante la administración de fármacos como la tetraciclina, lo que otorga reversibilidad y seguridad al proceso terapéutico. Asimismo, la integración de los adipocitos modificados con dispositivos de andamiaje polimérico biodegradables mejora su viabilidad y facilita su implantación y extracción, permitiendo una terapia adaptable según la evolución clínica y metabólica del paciente.
El desarrollo de organoides adiposos tridimensionales ofrece un ambiente similar al tejido nativo que potencia la funcionalidad y la interacción con el microambiente tumoral. Esta estrategia abre un campo prometedor para la oncología metabólica, complementando y potenciando los tratamientos convencionales como cirugía, quimioterapia y radioterapia. El potencial de combinar AMT con terapias dirigidas, inhibidores metabólicos o inmunoterapias podría incrementar la eficacia general y reducir las recaídas tumorales. Además, esta aproximación podría extenderse a la prevención, especialmente en individuos con predisposición genética al cáncer, como portadores de mutaciones BRCA1/2, disminuyendo la proliferación de células premalignas y modulación del microambiente mamario para reducir el riesgo de transformación maligna. A pesar de los avances, es fundamental continuar explorando la seguridad a largo plazo de esta técnica, monitoreando posibles efectos adversos como la caquexia asociada con la activación excesiva del tejido adiposo marrón y estableciendo protocolos precisos para la regulación temporal de la expresión génica.
La investigación futura también deberá centrarse en optimizar las vías metabólicas objetivo según el tipo específico de tumor y el perfil metabólico individual del paciente. En definitiva, la implantación de adipocitos modificados representa una innovadora y versátil herramienta terapéutica en la batalla contra el cáncer, basada en la manipulación metabólica y la competencia por nutrientes. Este enfoque ofrece una terapia personalizada, con un impacto potencialmente significativo en la mejora de la supervivencia y calidad de vida de los pacientes oncológicos.