El metabolismo del carbono de un solo átomo es una ruta bioquímica fundamental que sostiene la salud celular y participa en múltiples procesos vitales, desde la génesis de nucleótidos hasta la regulación epigenética. Cuando esta red metabólica presenta disfunciones, las células neuronales se vuelven vulnerables a daños y muertes, originando patologías neurodegenerativas como el glaucoma, una de las principales causas de ceguera irreversible en el mundo. Estudios recientes han identificado que ciertos déficits en este sistema pueden ser mitigados mediante la suplementación con vitaminas específicas, destacando el papel neuroprotector de las vitaminas B6, B9, B12 y la colina. En este contexto, conocer la relación entre el metabolismo del carbono y la función neuroprotectora de estas vitaminas abre una ventana prometedora para nuevas estrategias terapéuticas. El glaucoma es una enfermedad que induce la pérdida progresiva de células ganglionares de la retina, las neuronas responsables de transmitir la información visual al cerebro.
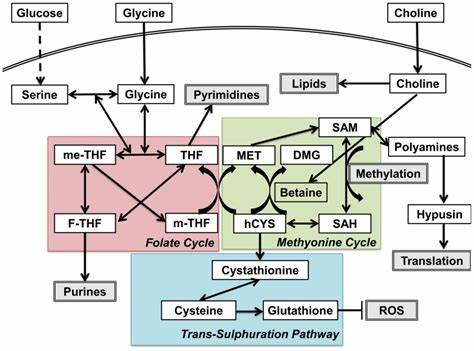
Tradicionalmente se ha relacionado al glaucoma con la presión intraocular elevada, sin embargo, distintos estudios demuestran que esta no es la única causa ni el único factor de riesgo. En esta línea, la disfunción metabólica temprana en la retina y el nervio óptico emerge como un elemento crítico en el desarrollo y progresión de la enfermedad. Investigaciones han revelado que el metabolismo del carbono de un solo átomo se encuentra alterado en las etapas iniciales del glaucoma, antes de que se produzca la muerte neuronal observable. El metabolismo del carbono de un solo átomo comprende rutas bioquímicas que utilizan y transfieren grupos metilos (un átomo de carbono junto con tres hidrógenos) en numerosas reacciones celulares. Entre las principales vías involucradas están el ciclo de metionina, la vía de transulfuración y el ciclo del folato, las cuales funcionan coordinadamente para mantener la homeostasis celular.
Un metabolito clave en estas rutas es la homocisteína, un aminoácido no codificante dependiendo del cual se controla la regeneración de metionina y la producción de glutatión, un antioxidante vital. En el glaucoma, niveles elevados de homocisteína en la retina se han asociado con un estrés metabólico que induce daño neuronal. Aunque la administración aguda de homocisteína en grandes concentraciones puede causar muerte de células ganglionares, estudios específicos señalan que elevaciones en niveles fisiológicos pueden aumentar ligeramente la sensibilidad de estas neuronas a otros factores estresantes, como la hipertensión ocular. Por tanto, la concentración de este metabolito parece actuar más como un marcador de la disfunción más que como un agente causal único de la degeneración. Las alteraciones en la expresión genética de importantes enzimas involucradas en la metabolización de la homocisteína, tales como metionina sintasa y cistationina beta sintasa, han sido documentadas en modelos animales de glaucoma.
Estas modificaciones generan un desequilibrio en la capacidad de reciclar homocisteína y producen un aumento de este aminoácido perjudicial. Sumado a esto, la producción y utilización de cofactores esenciales, como las vitaminas B6, B9 y B12, quedan comprometidas, lo que agrava el déficit metabólico. Las vitaminas del complejo B y la colina son imprescindibles para que estas rutas metabólicas funcionen correctamente. La vitamina B6, en forma activa de piridoxal 5'-fosfato, actúa como coenzima en la conversión de homocisteína a cistationina, ayudando a disminuir su concentración. La vitamina B9 o folato es precursora en el ciclo del folato, permitiendo la transferencia de grupos metilo necesarios para la regeneración de metionina a partir de homocisteína.
La vitamina B12, en su forma activa metilcobalamina, es crucial para la actividad de la metionina sintasa, catalizando la conversión que reduce la homocisteína. Por último, la colina puede actuar como donador indirecto de grupos metilos, formando betaína, otro sustrato para la regeneración de metionina. Investigaciones in vivo han demostrado que la administración oral de estas vitaminas inyecta un impulso neuroprotector. En modelos animales de glaucoma, la administración conjunta de B6, B9, B12 y colina produjo una preservación significativa de la densidad y función de las células ganglionares, a pesar de la presencia de presión intraocular elevada. Este efecto neuroprotector se manifestó incluso cuando las intervenciones no afectaron a la presión ocular, confirmando un mecanismo independiente de este factor de riesgo tradicional.
Asimismo, los tratamientos con estas vitaminas impidieron la degeneración axonal y mantuvieron la integridad estructural del nervio óptico, vital para la transmisión eficiente de señales visuales. No obstante, la protección no fue absoluta, lo que sugiere que estas vitaminas forman parte de un abordaje multifacético necesario para frenar el daño neurodegenerativo de manera óptima. En estudios clínicos y epidemiológicos que examinaron la relación entre niveles plasmáticos de homocisteína y progresión del glaucoma, no se encontró evidencia contundente de que la concentración sistémica de homocisteína tenga un impacto significativo en el avance de la enfermedad. Sin embargo, esto no invalida la importancia del metabolito a nivel local en el tejido retiniano, donde el metabolismo y su regulación son más específicos. Por ello, el uso de suplementos vitamínicos que favorezcan el metabolismo local de uno-carbono tiene potencial beneficioso que justifica la exploración clínica.
Más allá del glaucoma, las implicaciones de la disfunción del metabolismo del carbono de un solo átomo se extienden a otras enfermedades neurodegenerativas como el Alzheimer y neuropatías ópticas relacionadas con deficiencias vitamínicas. En estos casos, las vitaminas B6, B9 y B12 han demostrado beneficios para reducir la inflamación, mejorar la reparación del ADN, regular la metilación del ADN y proteger contra el estrés oxidativo, todos mecanismos muy relacionados con la supervivencia neuronal. Desde el punto de vista molecular, la función de estas vitaminas en la regulación epigenética es especialmente relevante. La generación apropiada de S-adenosilmetionina (SAM) garantiza la disponibilidad de grupos metilo para la metilación del ADN y las histonas, procesos que modulan la expresión génica. La alteración de estas modificaciones puede desencadenar desajustes en la expresión de genes esenciales para la salud nerviosa y facilitar la neurodegeneración.
Por lo tanto, mantener un metabolismo eficiente del uno-carbono mediante el aporte vitamínico puede preservar la correcta regulación epigenética y neuronal. Un aspecto importante a considerar es la seguridad y la dosificación de estos suplementos. Aunque las vitaminas B6, B9 y B12 son generalmente seguras en dosis recomendadas, es esencial un equilibrio para evitar posibles efectos secundarios, como el antagonismo o la acumulación de metabolitos no deseados. El exceso de ácido fólico (B9 sintética) puede enmascarar deficiencias de vitamina B12, potencialmente generando neuropatías. Por ello, la administración combinada y controlada resulta esencial para asegurar los beneficios sin riesgos.
La evidencia disponible y el perfil favorable de seguridad hacen que la suplementación con estas vitaminas sea una opción atractiva para su aplicación clínica en pacientes con glaucoma y, posiblemente, en otras enfermedades neurodegenerativas. Los próximos pasos incluyen la realización de ensayos clínicos que evalúen su efectividad real en la preservación visual y el retraso de la progresión de la enfermedad, así como investigaciones que concreten los mecanismos exactos mediante los cuales ejercen su efecto neuroprotector. En definitiva, el metabolismo del carbono de un solo átomo emerge como un eje clave en la neuroprotección de células ganglionares retinianas. La disfunción de esta ruta metabólica señala una vulnerabilidad celular que puede ser abordada con la suplementación adecuada de vitaminas B6, B9, B12 y colina. Integrar este conocimiento en la estrategia terapéutica actual del glaucoma podría mejorar considerablemente la calidad de vida y resultados para millones de pacientes afectados a nivel global.
La comprensión de los procesos metabólicos complejos detrás de enfermedades neurodegenerativas está en constante evolución, y el enfoque en el metabolismo de uno-carbono representa un prometedor campo de investigación y tratamiento. Estos avances reflejan un cambio paradigmático hacia la prevención y protección neuronal temprana, más allá del manejo tradicional de síntomas o factores de riesgo aislados. La interconexión de la nutrición, genética y función metabólica abre nuevas vías para el cuidado personalizado y efectivo en oftalmología y neurología.