El cáncer continúa siendo uno de los principales desafíos en la salud mundial, con millones de diagnósticos anuales y múltiples obstáculos en la búsqueda de tratamientos efectivos y duraderos. En este contexto, la investigación biomédica ha explorado una amplia variedad de enfoques para atacar el crecimiento tumoral y limitar la progresión de la enfermedad. Un reciente avance en este campo se centra en la implantación de adipocitos modificados, células especializadas en almacenar y metabolizar grasas, que han sido genéticamente programadas para competir con las células cancerosas por los nutrientes esenciales, logrando así suprimir el desarrollo tumoral en modelos experimentales. Esta novedosa estrategia abre una ventana esperanzadora para nuevas terapias contra el cáncer, basadas en la manipulación metabólica y la reprogramación celular. Las células cancerígenas tienen una característica distintiva: su necesidad aumentada y específica de nutrientes para sostener su rápida proliferación y crecimiento.
Por lo general, estas células consumen grandes cantidades de glucosa y ácidos grasos, reprogramando sus rutas metabólicas para sobrevivir en entornos donde los recursos son limitados. Esta adaptación, conocida como el “efecto Warburg”, implica una alta dependencia de la glucólisis aeróbica, incluso en presencia de oxígeno, favoreciendo la producción rápida de energía y la generación de intermediarios para la síntesis celular. Además, durante condiciones de estrés como la hipoxia, las células tumorales incrementan el uso de lípidos como fuente energética, dado que los ácidos grasos proveen más del doble de energía que la glucosa. Frente a esta demanda metabólica elevada, los adipocitos representan un componente clave del microambiente tumoral, no solo por su capacidad de almacenar lípidos sino también por sus funciones endocrinas y metabólicas. Estudios recientes revelan que la manipulación de estos adipocitos puede ser una vía efectiva para modificar el entorno tumoral y limitar la disponibilidad de nutrientes esenciales para las células malignas.
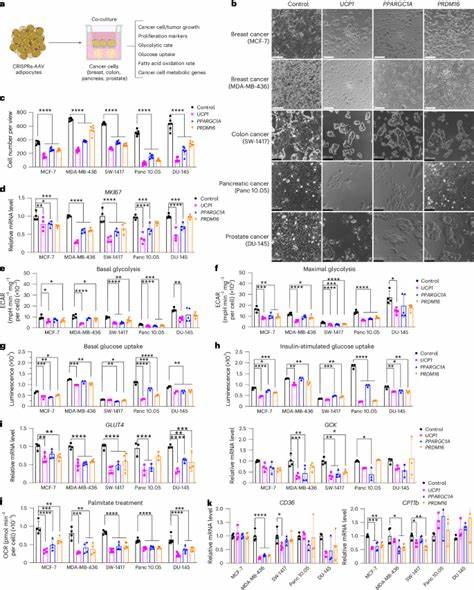
En particular, la implantación de adipocitos “ingenierizados” o modificados genéticamente para aumentar su capacidad de captar y metabolizar glucosa y ácidos grasos ha mostrado resultados significativos en la supresión del crecimiento tumoral en modelos preclínicos. Uno de los elementos centrales en este proceso es la activación del gen UCP1 (proteína desacoplante 1), característico de la grasa parda o marrón, especializado en la conversión de energía almacenada en calor a través de la termogénesis. Mediante técnicas avanzadas de edición genética dirigidas por CRISPR activador (CRISPRa), los adipocitos blancos se pueden reprogramar para adquirir características semejantes a las células de grasa marrón, aumentando así su consumo energético. Esta tendencia a la “pardeamiento” adiposo mejora la captación de glucosa y la oxidación de ácidos grasos, generando una competencia intensa con las células tumorales por estos nutrientes clave. Pruebas in vitro empleando sistemas de co-cultivo evidencian que adipocitos modificados con UCP1 y otros reguladores termogénicos como PPARGC1A y PRDM16 logran disminuir la proliferación de diversas líneas tumorales, incluyendo cáncer de mama, colon, páncreas y próstata.
Los estudios demuestran que, aunque las células adiposas y cancerosas no establecen contacto directo, el efecto metabólico de estos adipocitos activados reduce significativamente la capacidad de las células tumorales para capturar glucosa y ácidos grasos, afectando sus vías respiratorias y de síntesis. Esta restricción metabólica detiene el crecimiento tumoral y puede inducir apoptosis o muerte celular programada en estos tejidos malignos. Los ensayos in vivo implementados en modelos murinos inmunodeficientes refuerzan estos hallazgos. La coimplantación subcutánea de organoides adiposos humanos modificados con el sistema CRISPRa junto a xenoinjertos tumorales ha evidenciado una notable reducción en el tamaño tumoral, acompañada de una disminución de la hipoxia y la angiogénesis, condiciones esenciales para la progresión y metastatización tumoral. Esta técnica, denominada transplante manipulado de tejido adiposo, además de afectar el metabolismo local, genera efectos sistémicos, mejorando la sensibilidad a la insulina, reduciendo los niveles plasmáticos de glucosa y de insulina y aumentando el consumo de oxígeno general del organismo.
Dichos cambios metabólicos colocan al anfitrión en un estado menos favorable para el crecimiento tumoral. La personalización del abordaje también se ha explorado al manipular genes distintos como UPP1, involucrado en el metabolismo de la uridina, relevante en algunos subtipos de adenocarcinoma pancreático dependientes de esta molécula. Al elevar la expresión de UPP1 en adipocitos implantados, estos pueden competir efectivamente con tumores por la uridina, causando una reducción del crecimiento tumoral específico bajo condiciones de baja glucosa. Otro aspecto importante de este enfoque es la capacidad de inducir la expresión genética deseada en las células adiposas de manera reversible, mediante el uso de sistemas Tet-On activados por tetraciclina o su derivado, la doxiciclina. Esta regulación permite controlar temporalmente la actividad metabólica de los adipocitos implantados, limitando posibles efectos adversos o ajustes según la evolución del tumor.
Además, dispositivos integrados de andamiaje celular hechos con materiales biocompatibles como el policaprolactona permiten albergar y mantener los organoides adiposos con alta viabilidad y controlar su localización, favoreciendo la integración precisa y la extracción en caso necesario. El método de obtención de las células adiposas también aporta ventajas clínicas, ya que adipocitos derivados de tejido adiposo blanco obtenidos por liposucción o tejido resecado durante cirugías reconstructivas pueden ser aislados, manipulados ex vivo y reimplantados en el mismo paciente, reduciendo el riesgo de rechazo inmunológico y facilitando la aplicación en medicina personalizada. Tal estrategia es particularmente atractiva para tumores de mama, donde la manipulación del tejido adiposo autólogo puede combinarse con procedimientos reconstructivos post-mastectomía. El éxito de este enfoque destaca una importante interacción entre el metabolismo celular y el microambiente tumoral y subraya la posibilidad de utilizar células modificadas para alterar significativamente la disponibilidad de nutrientes esenciales para el tumor, condicionando su supervivencia. Este paradigma terapéutico rompe con las aproximaciones clásicas que buscan atacar directamente a las células tumorales y propone generar un entorno hostil desde la competencia metabólica.
A pesar de los resultados prometedores, es importante considerar algunas limitaciones y desafíos. La preocupación de un posible desarrollo de caquexia asociada a la acelerada metabolización inducida por adipocitos marrones puede ser mitigada gracias a sistemas de regulación inducible y plataformas extraíbles, pero necesita una evaluación cuidadosa en estudios a largo plazo. La implementación clínica requerirá también asegurar la seguridad genómica de las células modificadas y la optimización en la producción y almacenamiento de organoides adiposos para su uso terapéutico. Además, esta técnica no reemplaza completamente los tratamientos actuales, sino que puede integrarse de manera complementaria con cirugía, radioterapia, inmunoterapia y quimioterapia para mejorar los resultados clínicos. La versatilidad de la estrategia permite futuras adaptaciones específicas a distintos tipos de cáncer y sus perfiles metabólicos individuales, destacando su importante potencial para la oncología personalizada.
En conclusión, la implantación de adipocitos genéticamente modificados representa una innovación significativa en la lucha contra el cáncer. Al redirigir el metabolismo del microambiente tumoral y limitar la disponibilidad de nutrientes claves, esta técnica disminuye eficazmente el crecimiento y progresión tumoral en múltiples modelos cancerígenos. Los avances en edición genética, cultivo de organoides y diseño de plataformas de implantación posibilitan una futura aplicación clínica de esta terapia, que podría revolucionar el tratamiento oncológico ofreciendo una alternativa o complemento a las terapias tradicionales, además de contribuir a mejorar la calidad de vida y pronóstico de pacientes afectados por esta compleja enfermedad.