La comprensión profunda de la distribución espacial de biomoléculas en tejidos multicelulares es crucial para revelar sus funciones fisiológicas y patologías asociadas. Entre las técnicas emergentes, la imagen por espectrometría de masas (MSI, por sus siglas en inglés) se ha destacado por su capacidad de mapear biomoléculas directamente en tejidos sin necesidad de marcadores. Sin embargo, uno de los principales retos de MSI tradicional es su limitada resolución espacial, que dificulta la observación detallada a nivel celular y subcelular. Aquí es donde TEMI (Tissue-expansion mass-spectrometry imaging) entra en juego como una herramienta revolucionaria que combina la expansión física del tejido con MSI para lograr un mapeo molecular con resolución unicelular sin sacrificar velocidad o sensibilidad. TEMI se basa en un concepto innovador: expandir físicamente las muestras de tejido antes de realizar la imagen por espectrometría de masas.
Este enfoque aprovecha un proceso de gelling donde los componentes proteicos del tejido se anclan químicamente en una red hidrogel, permitiendo que el tejido se expanda isotrópicamente al ser inmerso en soluciones acuosas. A diferencia de métodos convencionales de expansión tisular que aplican altas temperaturas o enzimas proteolíticas para facilitar la expansión, TEMI evita la desnaturalización y proteólisis, preservando así la integridad de las biomoléculas ancladas como lípidos, metabolitos, péptidos y glicanos. El principal beneficio de esta técnica es la mejora notable de la resolución espacial. En la práctica, la expansión entre dos y tres veces el tamaño original del tejido reduce proporcionalmente el tamaño efectivo del vóxel analizado por el láser durante la espectrometría de masas. Esto permite que, con un estándar relativamente grueso de rayo láser de 50 micrómetros, la resolución espacial efectiva mejore hasta cerca de 17 micrómetros, suficiente para distinguir características a escala unicelular dentro del tejido.
Incluso se ha demostrado que con múltiples rondas de re-encapsulamiento y expansión, la resolución puede afinarse hasta alcanzar niveles con capacidad para observar células individuales, como las células Purkinje en el cerebelo de ratones. Otro aspecto fundamental del TEMI es la retención química y la distribución espacial fiel de biomoléculas. En métodos anteriores que requieren tratamientos térmicos o enzimáticos agresivos, se ha observado una pérdida significativa de señales, especialmente para lípidos y metabolitos pequeños, debido a la degradación o la difusión durante el proceso. TEMI mantiene la red proteica en su estado nativo, lo que permite que las moléculas menos solubles o asociadas a proteínas permanezcan localizadas en su sitio original, mejorando la fidelidad del mapeo. Esto se ha validado mediante análisis de lípidos extraídos del tejido expandido comparados con tejidos no tratados, donde la pérdida de señal es mínima cuando se evita el uso de proteasas.
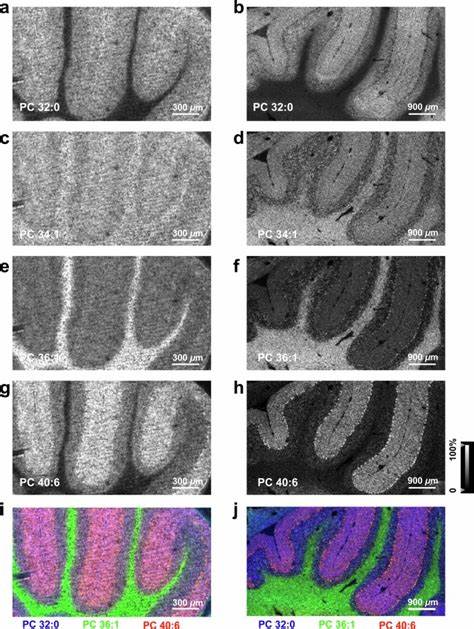
El proceso de preparación de muestras para TEMI también está optimizado para evitar interferencias en la etapa de desorción/ionización propia de MALDI-MSI. La expansión sin desnaturalización mantiene la uniformidad de la membrana del hidrogel, evitando capas irregulares que puedan impedir el paso del láser o afectar la formación del cristales de la matriz, factores críticos para la calidad de las imágenes MSI. Además, el protocolo incluye la criosección efectiva del tejido expandido que, gracias a tratamientos específicos con sucrosa y gelatina, garantiza cortes reproducibles y delgados de aproximadamente 30 micrómetros, esenciales para imágenes tridimensionales más precisas. El impacto de TEMI ha sido validado en el tejido cerebeloso de ratones, donde se logró mapear diferentes especies lipídicas que corresponden a capas funcionales específicas, evidenciando la heterogeneidad molecular en correlación con la estructura histológica clásica. Por ejemplo, se identificaron fosfatidilcolinas (PC) con alcances moleculares diferenciados para la capa molecular, la capa de células granulares y la sustancia blanca.
Más allá de los lípidos, TEMI permite también la detección y mapeo de metabolitos pequeños, como colina y derivados de ácidos grasos, así como péptidos liberados tras digestión in situ y glicanos N-conjugados mediante la aplicación localizada de enzimas específicas, todo ello preservando la información espacial original. Un área especialmente prometedora es el análisis de tumores, donde la heterogeneidad metabólica y molecular es una característica clave del microambiente tumoral. TEMI ha demostrado su capacidad para segmentar muestras tumorales implantadas en modelos murinos en múltiples regiones moleculares distintas, con una resolución muy superior a la obtenida en tejidos no expandidos. Esta ventaja abre una ventana para estudios profundos del metabolismo tumoral y la identificación de biomarcadores espaciales con potencial diagnóstico y terapéutico. Más allá del cerebro y el tejido tumoral, TEMI se ha implementado con éxito en riñón y páncreas de ratón, revelando la distribución espacial característica de diferentes lipídicos en estos órganos.
La versatilidad del método sugiere que puede adaptarse a una amplia variedad de tejidos y modalidades analíticas, incluyendo modalidades distintas de MSI como la desorción electrospray y la ablación láser electrospray. La técnica también admite integración con métodos complementarios, ciertamente el uso de inmunohistoquímica acoplada a MALDI-MSI con anticuerpos marcados con masas fotoactivables, lo que permite la detección dirigida de proteínas específicas con detalle espacial. Sin embargo, es importante considerar que el anclaje químico durante la expansión puede afectar epítopos y por ende la afinidad antigénica, requiriendo optimizaciones adicionales para un multiplexado eficiente. Desde la perspectiva técnica, fomentando la aplicación de TEMI es la ausencia de dependencia de equipamiento de espectrometría de masas especializado de costos prohibitivos. Al contrario, la expansión tisular actúa como un amplificador físico de resolución, permitiendo el uso de instrumentos relativamente estándar para alcanzar resoluciones similares o superiores a las obtenidas con sistemas de láseres ultrafinos y prolongados tiempos de adquisición.
Esto representa un punto clave para democratizar el acceso a la imagen molecular de alta resolución en laboratorios biomédicos y clínicos. Pese a sus evidentes ventajas, TEMI presenta retos que motivan futuras investigaciones. A medida que la expansión aumenta, la densidad intrínseca de biomoléculas por unidad de volumen disminuye, lo que puede afectar la sensibilidad de detección en zonas de interés crítico. Además, las moléculas pequeñas extremadamente solubles o libres podrían experimentar difusiones parciales durante la expansión, incluso con anclajes proteicos. Desarrollar estrategias químicas para inmovilizar estas moléculas es un área activa de investigación.