En el fascinante mundo del descubrimiento de nuevos fármacos, la innovación tecnológica y los recursos naturales han encontrado una sorprendente alianza que promete cambiar el ritmo y la eficiencia con la que se desarrollan medicamentos. La inteligencia artificial, especialmente el aprendizaje automático basado en conjuntos de datos pequeños, junto con el veneno de caracol, están emergiendo como elementos clave para acelerar este proceso crucial en la medicina. Esta combinación inusual entre una tecnología avanzada y un recurso biológico tradicional abre oportunidades para tratar enfermedades de manera más rápida y efectiva, optimizando recursos y descubriendo compuestos con gran potencial terapéutico. El descubrimiento de fármacos tradicionalmente ha estado rodeado de desafíos significativos, como la necesidad de grandes volúmenes de datos experimentales para validar la eficacia y seguridad de las moléculas candidatas, junto con largos períodos de investigación que pueden tardar años o incluso décadas. En este contexto, el aprendizaje automático ha irrumpido como una herramienta esencial para superar estas limitaciones.
Sin embargo, muchos modelos de inteligencia artificial requieren ingentes cantidades de datos, y en el ámbito biomédico, la disponibilidad de grandes bases de datos experimentales es a menudo limitada por costos, tiempo y acceso a muestras biológicas. Por ello, el desarrollo de técnicas de aprendizaje automático con poca cantidad de datos, conocido también como low-data machine learning, ha cobrado una importancia crucial. El aprendizaje automático con pocos datos es un avance revolucionario porque puede extraer patrones útiles y predecir resultados fiables sin la necesidad de enormes bases de datos. Esto es especialmente valioso en el estudio de compuestos bioactivos complejos que son difíciles de sintetizar o aislar en grandes cantidades. En el caso del veneno de caracol, específicamente de especies marinas como los caracoles cono, la situación es aún más crítica.
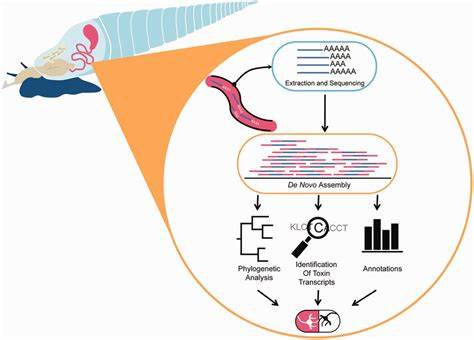
Estos caracoles producen una vasta y muy variada gama de péptidos con potentes propiedades farmacológicas, pero obtener grandes cantidades de estos compuestos para estudio es complicado y costoso. Los péptidos presentes en el veneno de caracol han llamado la atención de la comunidad científica debido a su especificidad y eficacia en interacciones con canales iónicos y receptores neuronales. Estas propiedades los hacen candidatos ideales para el desarrollo de nuevos analgésicos, tratamientos para enfermedades neurológicas y ciertas patologías cardiovasculares. Sin embargo, la complejidad estructural de estos péptidos y la dificultad para estudiar sus efectos en modelos preclínicos han limitado su avance en el pipeline farmacéutico tradicional. Aquí es donde cobra protagonismo el aprendizaje automático con poca cantidad de datos, permitiendo predecir la actividad biológica de nuevos péptidos con alta precisión sin necesidad de realizar experimentos extensos.
Mediante la integración de datos experimentales disponibles y modelos computacionales avanzados, es posible identificar, clasificar y priorizar moléculas prometedoras del veneno de caracol. Esto reduce considerablemente el tiempo y los recursos dedicados a la etapa de descubrimiento, permitiendo que se enfoquen esfuerzos en las moléculas con mayor potencial terapéutico. La aplicación de estas metodologías ha sido contemplada para acelerar el proceso investigativo centrado en la medicina personalizada y el desarrollo de fármacos más específicos y menos invasivos. La adaptabilidad del aprendizaje automático con pocos datos es clave en contextos donde la diversidad biológica es alta y los experimentos complejos y costosos, características propias de los estudios con toxinas naturales como el veneno de caracol. A través de esta sinergia tecnológica y biológica, se abren nuevas vías para investigar no solo en el ámbito de la farmacología sino también en áreas como la neurobiología y la biotecnología.
Además, el uso del veneno de caracol como fuente natural tiene una ventaja ecológica fundamental: mientras se estudian sus péptidos podemos evitar la extracción masiva o la destrucción de ecosistemas marinos delicados, enfocándonos en técnicas que integren la síntesis química y la modelización computacional. Esto hace que la investigación no solo sea más eficiente sino también más sostenible y respetuosa con el medio ambiente. Los diseños computacionales basados en inteligencia artificial permiten no solo identificar nuevos péptidos y estudiar su posible función, sino también optimizar su estructura molecular para mejorar su estabilidad, biodisponibilidad y eficacia terapéutica. Gracias a estas innovaciones, se ha logrado ampliar la biblioteca de compuestos candidatos y acelerar la transición de la fase in vitro a estudios preclínicos. Es importante destacar que este enfoque interdisciplinario demanda la colaboración estrecha entre biólogos, químicos, ingenieros en computación y expertos en inteligencia artificial, consolidando un campo emergente en el que convergen diversas áreas del conocimiento.
Las inversiones en tecnologías computacionales y la digitalización de datos biomoleculares son indispensables para mantener y potenciar esta tendencia. En conclusión, la fusión entre aprendizaje automático con baja cantidad de datos y el estudio del veneno de caracol representa una revolución en el descubrimiento y desarrollo de fármacos. No solo mejora la eficiencia y aceleración de los procesos, sino que contribuye a una investigación más sostenible y dirigida que puede ofrecer soluciones innovadoras para el tratamiento de múltiples enfermedades. A medida que esta tecnología madura, es probable que veamos un incremento significativo en la cantidad y calidad de nuevos medicamentos derivados de fuentes naturales, impulsados por modelos computacionales cada vez más sofisticados y adaptativos.