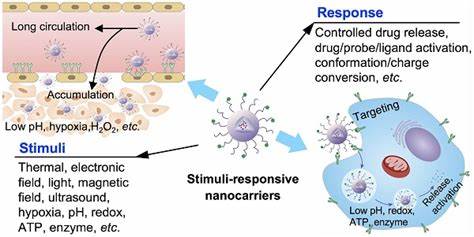
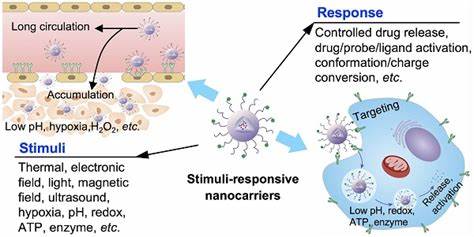
Las infecciones bacterianas crónicas siguen siendo un desafío importante para la medicina moderna, especialmente cuando estas infecciones están asociadas a la formación de biopelículas. Estas biopelículas son comunidades complejas de bacterias que se adhieren a superficies y producen una matriz extracelular protectora llamada matriz de polisacáridos extracelulares (EPS) que dificulta la penetración de los antimicrobianos convencionales. Debido a esta barrera física y la presencia de células bacterianas en estados metabólicamente inactivos o persistentes, las terapias estándar suelen ser insuficientes, llevando a tratamientos prolongados y en muchos casos a intervenciones invasivas como cirugías. Frente a este panorama, la innovación en sistemas de liberación de medicamentos activados por ultrasonido presenta un avance tecnológico que puede cambiar el paradigma en el manejo de estas infecciones crónicas. La clave para superar la resistencia aumentada que ofrecen las biopelículas radica en el desarrollo de plataformas nanotecnológicas que permitan la liberación localizada y controlada de antimicrobianos directamente en la matriz biofilmica, maximizando la concentración efectiva del fármaco y evitando la toxicidad sistémica.
Entre estas, las nanogotas de perfluorocarbono recubiertas por fosfolípidos, conocidas también como nanodroplets, han captado la atención reciente por su capacidad de responder a la activación con ultrasonido terapéutico. Estas nanodroplets, de pequeño tamaño (aproximadamente entre 125 y 250 nanómetros), contienen antimicrobianos específicos que pueden ser liberados de forma controlada mediante la aplicación de ultrasonido focalizado, que induce la vaporización del perfluorocarbono, transformando la nanodroplet líquida en microburbujas efímeras cuya oscilación y colapso favorecen la disrupción mecánica de la biopelícula y facilitan la penetración del fármaco. El desarrollo de estas nanodroplets responde a una necesidad clínica apremiante: tratar eficazmente patógenos resistentes comúnmente presentes en infecciones de piel crónicas, vías urinarias, pulmones en fibrosis quística y prótesis ortopédicas, entre otros. Específicamente, la formulación ha sido probada con cuatro clases diferentes de agentes antimicrobianos, incluyendo la azitromicina - un inhibidor de la comunicación bacteriana o quorum sensing -, el besifloxacino - un fluoroquinolona de última generación -, la polymixina B, un péptido antimicrobiano con acción sobre bacterias gramnegativas, y un innovador complejo de rutenio con propiedades antimicrobianas emergentes. Cada uno de estos agentes se incorpora aprovechando sus propiedades químicas para asegurar su estabilidad dentro de las nanodroplets y una liberación efectiva al momento de la activación por ultrasonido.
La aplicación clínica de esta tecnología se basa en la combinación sinérgica entre las propiedades físicas del ultrasonido y la mejora en la farmacocinética del agente antimicrobiano. Mientras el ultrasonido promueve la disgregación mecánica de la matriz biofilmica a través de la cavitación acústica, generando espacios y poros temporales en el EPS, las nanodroplets liberan concentraciones potentes de fármacos justo en el lugar deseado. Esta dualidad permite una penetración profunda del antimicrobiano en las capas más internas del biofilm, donde residen células dormantes y persisters que usualmente escapan a la acción de los antibióticos tradicionales. Estudios in vitro utilizando aislamientos clínicos resistentes, como Staphylococcus aureus multirresistente (MRSA) y E. coli productora de betalactamasas de espectro extendido (ESBL), han demostrado que la combinación de antimicrobianos encapsulados en nanodroplets y ultrasonido puede reducir hasta 44 veces la concentración de antibiótico necesaria para erradicar los biofilms comparado con el uso del medicamento libre.
Este ahorro es fundamental para minimizar efectos adversos y contrarrestar la evolución de resistencia bacteriana, ya que dosis elevadas o tratamientos prolongados suelen contribuir a la selección de cepas más resistentes. Además, el sistema ha mostrado especial eficacia para eliminar células persister, un subgrupo de bacterias inactivas metabólicamente cuya presencia está estrechamente relacionada con la recurrencia de infecciones. Otro aspecto clave de esta tecnología es la versatilidad del sistema nanodroplet para adaptarse a diferentes ambientes infecciosos simulados a través de medios artificiales que reproducen las condiciones fisiológicas de orina, líquido sinovial, esputo de fibrosis quística y entorno de heridas crónicas. Este enfoque asegura que los resultados no solo sean aplicables a condiciones de laboratorio estándar, sino que tengan relevancia clínica directa, considerando la complejidad y variabilidad del microambiente donde se desarrollan estas infecciones. Además de la eficacia antibiótica, la tecnología ofrece una mejora significativa en la distribución subcelular de los antimicrobianos.
Los análisis por espectrometría de masas con plasma acoplado inductivamente muestran que la encapsulación en nanodroplets alcanza concentraciones hasta once veces superiores en el citoplasma de bacterias inmersas en biofilms, comparado con el mismo fármaco en forma libre. Esto es crucial porque muchos antibióticos necesitan acceder a sitios intracelulares específicos para ejercer su acción letal. La liberación dirigida combinada con la permeabilización de membranas inducida por la cavitación contribuye a esta mayor acumulación, superando así uno de los principales obstáculos para el tratamiento efectivo de infecciones biofilmicas. A nivel de seguridad y estabilidad, las nanodroplets mantienen sus dimensiones, concentración y capacidad de respuesta ultrasónica por períodos prolongados, tanto en condiciones de suero como a temperatura ambiente, facilitando su almacenamiento y potencial traslado a entornos clínicos. Este factor es vital para la implementación práctica y la posterior aprobación regulatoria de la tecnología.
La tecnología usa un equipo de ultrasonido comercial estándar, lo que facilita su integración en el sistema de salud actual sin requerir dispositivos especializados, costosos o poco disponibles. Esto también acelera la traslación clínica al adoptar tecnologías ya conocidas y ampliamente utilizadas. Mirando hacia el futuro, esta plataforma se puede expandir para incorporar nuevos agentes antimicrobianos, incluyendo moléculas antibiofilm novedosas, enzimas que degradan la matriz del biofilm o gases bioactivos con propiedades antimicrobianas. Estas combinaciones podrían mejorar aún más la capacidad para prevenir la formación de resistencia y eliminar biofilms persistentes. En conclusión, el desarrollo de sistemas de liberación de antimicrobianos activados por ultrasonido mediante nanodroplets representa un avance significativo en el combate contra las infecciones asociadas a biopelículas resistentes.
Esta tecnología tiene el potencial de transformar el tratamiento de infecciones crónicas, reducir la necesidad de intervenciones quirúrgicas agresivas y mejorar la calidad de vida de millones de pacientes afectados en todo el mundo. La integración de nanotecnología, física aplicada y farmacología ofrece una solución multidisciplinaria a un problema biomédico complejo y en constante evolución. La inversión en investigación y desarrollo en este ámbito es una apuesta segura para la medicina del futuro, donde los tratamientos serán cada vez más precisos, efectivos y personalizados.