El cáncer sigue siendo uno de los mayores retos para la medicina moderna, dadas sus complejas características y su capacidad de adaptación para evadir tratamientos convencionales. A pesar de los avances en terapias dirigidas, inmunoterapia y quimioterapia, la lucha para detener eficazmente el crecimiento tumoral continúa siendo un desafío. Recientemente, investigadores han explorado una novedosa estrategia basada en la implantación de adipocitos diseñados genéticamente que pueden competir con las células cancerosas por nutrientes esenciales, logrando así ralentizar, e incluso suprimir, el progreso tumoral en modelos experimentales. Este enfoque innovador, conocido como trasplante de manipulación adiposa o AMT, abre nuevas perspectivas terapéuticas con un potencial significativo para el tratamiento de múltiples tipos de cáncer. Los tumores malignos presentan una característica metabólica distintiva que los diferencia de las células normales: exhiben una capacidad incrementada para captar y metabolizar nutrientes, especialmente glucosa y ácidos grasos, elementos imprescindibles para su rápido crecimiento y proliferación.
Este fenómeno metabólico, denominado efecto Warburg, se basa en la preferencia de las células cancerosas por la glucólisis aeróbica, incluso en presencia de oxígeno, lo que les proporciona intermediarios metabólicos para la división celular continua. La competencia por recursos es un fenómeno crucial en el microambiente tumoral, donde las células cancerosas se disputan oxígeno, glucosa y lípidos con otras células presentes en el tejido circundante. Teniendo esto en cuenta, el desarrollo de terapias que puedan interferir en esta competencia metabólica ha captado el interés científico. La implantación de adipocitos especialmente modificados representa una promesa en esta dirección. Estos adipocitos, comúnmente abundantes en el tejido adiposo blanco, son reprogramados mediante técnicas de activación genética para comportarse como tejido adiposo marrón o beige, denominado proceso de pardeamiento o browning.
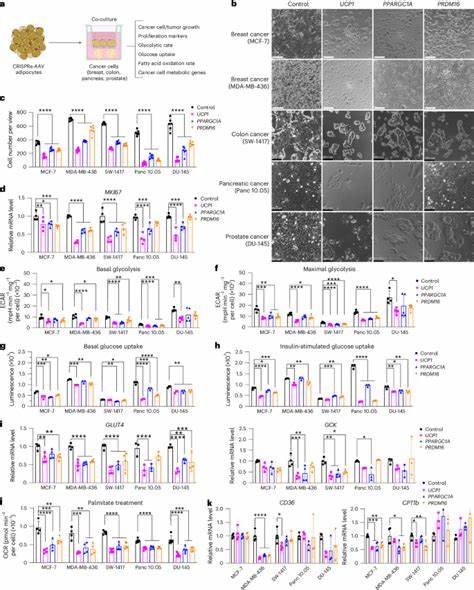
La importancia del tejido adiposo marrón radica en su capacidad para producir calor mediante la termogénesis sin escalofríos, un proceso que incrementa el gasto energético a través de la proteína desacoplante 1 (UCP1). La activación de UCP1 aumenta el consumo de glucosa y de ácidos grasos por parte de las adipocitos pardo-marrones, consumiendo así nutrientes disponibles y reduciendo el suministro necesario para el crecimiento tumoral. Para lograr esto, los científicos emplean sistemas de edición genética basados en CRISPR activador, que permiten la sobreexpresión de genes clave como UCP1, PPARGC1A y PRDM16 en adipocitos humanos blancos, promoviendo su transformación hacia un fenotipo marrón activo. A través de una estrategia que utiliza vectores virales adenoasociados (AAV) para administrar estos constructos en cultivos celulares, es posible generar adipocitos con metabolismo acelerado y alta capacidad de captación y degradación de glucosa y grasas. Experimentos in vitro han demostrado que la co-cultivación de estas células adiposas modificadas con diversas líneas celulares tumorales —incluyendo tipos de cáncer de mama, colon, páncreas y próstata— resulta en una marcada disminución de la proliferación tumoral.
Los adipocitos activados reducen significativamente la tasa de glicólisis y la oxidación de ácidos grasos por parte de las células cancerosas, evidenciando una competencia efectiva por los recursos energéticos en el microambiente celular. Este efecto metabólico altera la capacidad de las células tumorales para mantener su crecimiento y supervivencia. Los estudios en modelos animales corroboran estos hallazgos. En ratones inmunodeficientes con xenoinjertos tumorales, la implantación de organoides adiposos humanos modificados genéticamente limita el desarrollo tumoral y mejora parámetros asociados a la progresión cancerígena, tales como una disminución en la angiogénesis y la hipoxia tumoral. Además, la implantación tanto cerca como a distancia del tumor principal ha mostrado resultados positivos, destacando la capacidad sistémica de esta terapia.
Una ventaja sustancial de esta terapia reside en la posibilidad de ampliar el espectro de tratamiento mediante la personalización genética de las adipocitos según el perfil metabólico particular del tumor. Por ejemplo, ciertas neoplasias dependen del uridinato para su metabolismo; por medio de la sobreexpresión del gen UPP1 en adipocitos, es posible captar y limitar el acceso tumoral a esta molécula, inhibiendo su crecimiento en modelos preclínicos de adenocarcinoma pancreático. Esto demuestra la flexibilidad y adaptabilidad de esta terapia para dirigirse a distintas rutas metabólicas clave. Desde un punto de vista clínico, la obtención y manipulación de adipocitos cuenta con una ventaja significativa. El tejido adiposo puede ser extraído mediante técnicas mínimamente invasivas como la liposucción, procedimiento ya ampliamente usado en cirugía estética y reconstructiva.
La capacidad de aislar, modificar y reimplantar estos adipocitos en el mismo paciente permite idear terapias autólogas con reducido riesgo inmunológico. Además, el uso de organoides adiposos, estructuras tridimensionales que mejor emulan la complejidad del tejido nativo, mejora la integración y funcionalidad tras la implantación. Otra innovación clave relacionada con esta terapia es el desarrollo de sistemas inducibles y plataformas de implantación que permiten controlar la actividad del transgene a través de fármacos como la tetraciclina. Así, es posible modular la expresión de genes como UCP1 de forma reversible, adaptando la terapia a las evoluciones del tumor o a posibles efectos adversos. El uso de andamiajes biocompatibles y microambientes diseñados agrega un nivel adicional de control y estabilidad, facilitando el anclaje de los organoides en lugares específicos del tejido y permitiendo su extracción o reemplazo si fuera necesario.
Esta tecnología hace posible una terapia regulable, personalizable y con menor invasividad. Los estudios realizados también sugieren un impacto sistémico de estos adipocitos modificados en el metabolismo global del organismo, incluyendo una reducción en los niveles plasmáticos de insulina, hormona que además puede actuar como factor de crecimiento en algunos tumores. Por tanto, el efecto antitumoral podría ser una suma de la competencia local por nutrientes y la modificación del ambiente metabólico del huésped, con beneficios múltiples. La implantación de adipocitos marrones o beige reprogramados representa una alternativa o complemento interesante a las terapias convencionales que apuntan directamente a las células cancerosas. Su bajo potencial inmunogénico, facilidad de obtención y manipulación, así como su capacidad para dirigirse a rutas metabólicas críticas para la supervivencia tumoral los posicionan como una nueva frontera en la oncología celular.
No obstante, existen desafíos que requieren análisis adicional. La posible inducción de caquexia, síndrome caracterizado por pérdida de masa muscular y de grasa en pacientes con cáncer avanzados, debe ser monitoreada. El desarrollo de sistemas que permitan detener o revertir la actividad de los adipocitos implantados es fundamental para garantizar la seguridad a largo plazo. En conclusión, la implantación de adipocitos genéticamente modificados para aumentar su consumo metabólico y competir eficazmente con las células tumorales surge como una estrategia prometedora para el control de diversos tipos de cáncer. La personalización de esta terapia según las necesidades metabólicas particulares de cada tumor, sumada a la posibilidad de control farmacológico e implantación asistida por tecnología avanzada, ofrece un nuevo paradigma en el tratamiento oncológico.
La investigación continúa y podría llevar en el futuro cercano a nuevas opciones clínicas para pacientes con malignidades difíciles de tratar.