El cáncer continúa siendo uno de los mayores desafíos para la medicina moderna debido a su complejidad biológica y la capacidad de las células tumorales para adaptarse y sobrevivir en entornos adversos. Una de las estrategias más recientes y prometedoras para combatir el cáncer se centra en manipular el microambiente tumoral mediante la implantación de adipocitos (células grasas) modificados genéticamente para interferir en el metabolismo celular de los tumores y ralentizar su progresión. La base de esta innovación radica en comprender que las células cancerígenas tienen una alta demanda de nutrientes, especialmente glucosa y ácidos grasos, para sostener su rápido crecimiento y proliferación. Este metabolismo alterado, conocido popularmente como el “efecto Warburg”, implica un aumento en la captación y uso de glucosa principalmente a través de la glicólisis aeróbica, incluso en presencia de oxígeno, lo que les permite satisfacer sus necesidades energéticas y biosintéticas. Instrumentando esta vulnerabilidad metabólica, investigadores han desarrollado lo que se denomina la tecnología de Transplante de Manipulación Adiposa (AMT, por sus siglas en inglés).
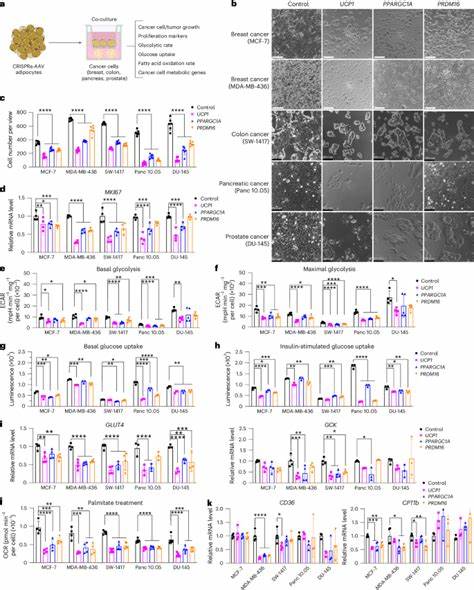
Este método consiste en la implantación de adipocitos especialmente diseñados para competir con las células tumorales por los nutrientes esenciales, limitando así la disponibilidad de estos elementos y restringiendo el crecimiento de los tumores. Para generar estos adipocitos modificados, se emplea la técnica de activación CRISPR (CRISPRa) que permite aumentar la expresión de genes clave responsables del “pardeamiento” o activación termogénica de las células grasas blancas, convirtiéndolas en un fenotipo similar a las células de grasa marrón. En particular, se ha destacado la importancia del gen UCP1 (proteína desacoplante 1), un regulador crítico del metabolismo energético que aumenta la oxidación de ácidos grasos y el consumo de glucosa en las adipocitos, generando calor en vez de almacenar energía. Al aumentar la expresión de UCP1, junto con otros genes reguladores como PPARGC1A y PRDM16, los adipocitos modificados exhiben una mayor capacidad para captar y metabolizar glucosa y lípidos, de manera que literalmente “quitan” los recursos que las células cancerosas necesitan para desarrollarse. Este mecanismo crea un fenómeno de competencia metabólica directa en el microambiente tumoral, limitando la disponibilidad de combustible y alterando la dinámica de crecimiento del cáncer.
Se ha demostrado en múltiples estudios preclínicos que la coimplantación de estos adipocitos ingenierizados junto a diferentes tipos de células cancerosas —incluyendo líneas de cáncer de mama, páncreas, colon y próstata— genera una significativa reducción en el crecimiento tumoral. Más allá de las células aisladas, la aplicación en organoides adiposos tridimensionales que replican características del tejido graso nativo ha potenciado estos efectos, mejorando la integración y la capacidad de respuesta al microambiente. El abordaje ha sido validado en modelos animales genéticos, donde la implantación ortotópica de estos organoides o adipocitos ‘pardeados’ redujo el tamaño y la progresión tumoral en cánceres de mama y páncreas. Se observaron también disminuciones en marcadores de proliferación celular, angiogénesis y niveles de hipoxia, todos indicadores indirectos de un microambiente menos favorable para la expansión tumoral. La eficacia de esta estrategia se vio modulada por la disponibilidad nutricional del organismo, ya que dietas altas en grasas o glucosa pueden contrarrestar la competencia por nutrientes impuesta por los adipocitos modificados, subrayando la importancia del contexto metabólico global para el éxito terapéutico.
Complementariamente, la adaptabilidad de esta tecnología permite su personalización para distintos perfiles metabólicos tumorales. Por ejemplo, en cánceres de páncreas dependientes de uridina, la modulación de otros genes como UPP1 (uridina fosforilasa 1) ha mostrado potencial para competir por esta vía metabólica específica y suprimir el crecimiento tumoral. Desde el punto de vista clínico, esta propuesta presenta notables ventajas. Los adipocitos pueden obtenerse fácilmente a partir del propio paciente mediante procedimientos mínimamente invasivos como la liposucción, manipulados genéticamente fuera del cuerpo para aumentar su capacidad metabólica y reimplantados cerca del tumor o en áreas distantes para ejercer un efecto sistémico. Esto reduce los riesgos de rechazo inmunológico y maximiza la compatibilidad.
Además, se han desarrollado sistemas para controlar la actividad de los genes introducidos mediante sistemas inducibles de expresión, utilizando tetraciclina o análogos para activar o desactivar la función terapéutica según se requiera, permitiendo un control preciso y reversible sobre la terapia. Otra innovación complementaria es la utilización de plataformas biomateriales, como andamios de policaprolactona (PCL), para facilitar la implantación, organización y supervivencia de los adipocitos modificados. Estos dispositivos permiten un alojamiento tridimensional óptimo y la integración tisular, mejorando la eficacia y facilitando la remoción o sustitución del implante si fuera necesario. El enfoque basado en AMT también abre la posibilidad de combinar la competencia metabólica con la secreción dirigida de factores terapéuticos, aprovechando la capacidad endocrina y secretora de los adipocitos, lo que podría aumentar aún más su acción antitumoral. Dentro del espectro de los desafíos, es importante considerar potenciales efectos secundarios como la caquexia cancerosa, una condición caracterizada por pérdida de tejido graso y muscular.
Sin embargo, gracias al diseño modular y controlable de la terapia, es posible minimizar riesgos al poder ajustar o retirar el tratamiento si se presentan complicaciones. En resumen, la implantación de adipocitos modificados representa una innovación disruptiva en el campo de la oncología, centrada en la manipulación metabólica para suprimir el crecimiento tumoral. Este enfoque no solo ofrece un tratamiento menos tóxico y más específico, sino que también se adapta a la heterogeneidad metabólica de los tumores, permitiendo una medicina personalizada. Con más desarrollo y ensayos clínicos, esta tecnología tiene el potencial de convertirse en una parte integral del arsenal terapéutico contra el cáncer, ofreciendo esperanza a millones de pacientes en el mundo.