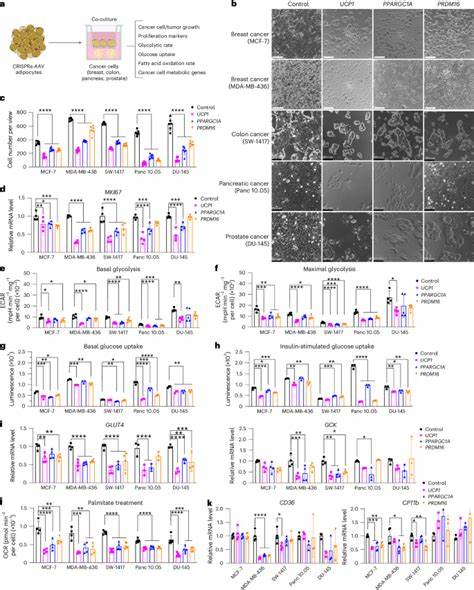
El cáncer es una enfermedad compleja caracterizada por la proliferación descontrolada de células que poseen una demanda nutricional elevada y una capacidad para reprogramar su metabolismo que les permite sobrevivir en microambientes restrictivos. Una de las estrategias emergentes en la lucha contra esta enfermedad se basa en atacar no solo las células cancerosas directamente, sino también su capacidad para apropiarse de nutrientes esenciales. En este contexto, la implantación de adipocitos ingenierizados representa una prometedora vía terapéutica que puede suprimir la progresión tumoral mediante la competencia directa por nutrientes críticos como la glucosa y los ácidos grasos. Los adipocitos, o células grasas, pueden ser modificados mediante tecnologías avanzadas de edición genética para aumentar su consumo metabólico. Este proceso, denominado pardeamiento o beigeamiento, convierte adipocitos blancos en células con características del tejido adiposo marrón, especializadas en la disipación energética a través de la termogénesis.
La proteína desacoplante 1 (UCP1) emerge como un factor clave, cuya sobreexpresión en adipocitos modifica su metabolismo hacia un mayor consumo de glucosa y ácidos grasos, otorgándoles la capacidad de competir con las células tumorales por estos recursos. Las investigaciones recientes han demostrado que la implantación subcutánea de organoides adiposos humanos modificados genéticamente para sobreexpresar UCP1 genera una notable disminución en el tamaño de diversos tumores en modelos animales, incluyendo cáncer de mama, páncreas y próstata. Esta técnica se conoce como transplante de manipulación adiposa (AMT, por sus siglas en inglés). AMT facilita la reducción del estrés por hipoxia y la angiogénesis en los tumores, dos aspectos fundamentales para el desarrollo y la agresividad del cáncer. Por otro lado, el mecanismo subyacente a esta supresión tumoral está asociado principalmente con una competencia metabólica directa.
Los adipocitos ingenierizados absorben significativamente más glucosa y lípidos, privando a las células cancerosas de los nutrientes necesarios para su crecimiento y supervivencia. Se ha evidenciado que esta privación reduce la tasa de proliferación tumoral, altera los procesos metabólicos asociadas a la glicólisis y la oxidación de ácidos grasos en las células cancerosas y favorece la inducción de apoptosis. Además de la acción local, AMT también puede ejercer efectos sistémicos favorables. La implantación de adipocitos modificados ha sido reportada por mejorar la tolerancia a la glucosa y la sensibilidad a la insulina a nivel corporal, impactando positivamente en el metabolismo general, lo que podría contribuir indirectamente a la reducción del crecimiento tumoral. Estas propiedades metabólicas enriquecen aún más el valor terapéutico de los adipocitos pardeados.
El enfoque AMT ha demostrado ser adaptable y personalizable. Más allá del pardeamiento asociado a UCP1, se ha explorado la activación de otras rutas metabólicas específicas que pueden ser cruciales para ciertos tipos de cáncer. Por ejemplo, la sobreexpresión de la enzima uridina fosforilasa 1 (UPP1) en adipocitos ha mostrado capacidad para competir por uridina, un nutriente relevante en el cáncer ductal pancreático, y así limitar su crecimiento en condiciones de restricción glucémica. Desde un punto de vista clínico, la extracción y manipulación ex vivo de adipocitos ofrece múltiples ventajas. El tejido adiposo puede obtenerse mediante liposucción o durante procedimientos quirúrgicos reconstructivos, como las mastectomías seguidas de reconstrucción mamaria.
La capacidad para modificar estos adipocitos usando tecnologías como CRISPR activadoras (CRISPRa) posibilita la edición dirigida y reversible, con la potencialidad de controlar la expresión génica mediante sistemas inducibles, por ejemplo, con tetraciclinas, y la implantación en dispositivos de liberación integrados que puedan facilitar su remoción o reemplazo cuando sea necesario. Una característica destacada de esta terapia es la baja inmunogenicidad de los adipocitos, que favorece la posibilidad de desarrollar terapias autólogas o incluso “off-the-shelf” con adipocitos pre-preparados. Esto contrasta con terapias basadas en células inmunoespecíficas, que requieren complejas estrategias para evitar el rechazo. Los estudios también han puesto de manifiesto que esta alternativa terapéutica es eficaz en líneas celulares y modelos de cáncer triple negativo y hormonodependiente, ampliando su potencial alcance. La evidencia obtenida en co-cultivos de adipocitos humanizados y organoides de tumor, así como en modelos murinos genéticos específicos, respalda el papel del AMT como estrategia innovadora para la supresión específica de tumores.
No obstante, existen retos por resolver antes de su aplicación clínica generalizada. Uno de ellos es la gestión del balance energético para evitar eventos de caquexia cancerosa, un síndrome que implica pérdida severa de masa muscular y grasa en pacientes, posiblemente potenciado por el aumento de actividad metabólica inducida por adipocitos pardeados. Por ello, el desarrollo de sistemas inducibles y reversibles es crucial para garantizar una terapia segura y adaptativa. En términos de perspectiva futura, la implantación de adipocitos modificados abre el camino hacia tratamientos combinados que integren AMT con quimioterapia, inmunoterapia o terapias dirigidas, buscando un efecto sinérgico contra la progresión tumoral. Además, el uso de orgánulos celulares para la secreción localizada de agentes terapéuticos o la modificación adicional del microambiente tumoral ofrece posibilidades innovadoras para personalizar aún más esta modalidad.
En conclusión, la implantación de adipocitos ingenierizados representa una revolución en el abordaje terapéutico del cáncer. Al aprovechar la competencia metabólica con células malignas, esta estrategia logra una disminución significativa en el crecimiento tumoral, mejora parámetros microambientales clave, y posee potencial para ser adaptable a múltiples tipos de neoplasias. La confluencia de avances en bioingeniería celular, edición genética y nanotecnología facilitará la transición rápida de este enfoque innovador hacia el ámbito clínico, con la promesa de ofrecer nuevas esperanzas en la lucha contra el cáncer.