El cáncer continúa siendo uno de los desafíos más complejos para la medicina moderna, impulsando la búsqueda incesante de nuevas terapias que logren mejorar el pronóstico y la calidad de vida del paciente. En este contexto, la reciente innovación en la ingeniería y implantación de adipocitos —células especializadas en el almacenamiento y metabolismo de lípidos— ha emergido como un prometedor enfoque para suprimir el progreso tumoral a través del control metabólico. Los tumores dependen de manera crítica de una abundante adquisición y metabolismo de nutrientes que les permitan sostener su rápida proliferación. Glucosa y ácidos grasos son especialmente relevantes como fuentes principales de energía y bloques fundamentales para la biosíntesis celular. Sin embargo, estas demandas generan un entorno microambiental hostil caracterizado por limitaciones en estos nutrientes esenciales y condiciones hipóxicas.
La capacidad de las células cancerosas para adaptarse metabólicamente incluye el conocido efecto Warburg, en el que optan por un metabolismo glucolítico incluso en presencia de oxígeno, privilegiando la explotación rápida de la glucosa. En este marco, la implantación de adipocitos bioingenierizados se presenta como un novedoso método terapéutico que utiliza adipocitos modificados para competir eficazmente con las células tumorales por esos recursos clave. Este procedimiento, denominado trasplante de manipulación adiposa (AMT por sus siglas en inglés), consiste en modificar adipocitos blancos humanos para inducir un fenotipo similar al tejido adiposo marrón o beige. Dichos adipocitos 'marrones' se caracterizan por su elevada capacidad metabólica para absorber glucosa y ácidos grasos, además de disipar energía a través de la termogénesis, gracias a la expresión aumentada de proteínas desacopladoras como la UCP1 (proteína desacopladora 1). Mediante técnicas de activación genética como CRISPRa, se han logrado fabricar adipocitos con niveles incrementados de expresión de genes fundamentales para la función del tejido adiposo marrón, incluyendo UCP1, PPARGC1A y PRDM16.
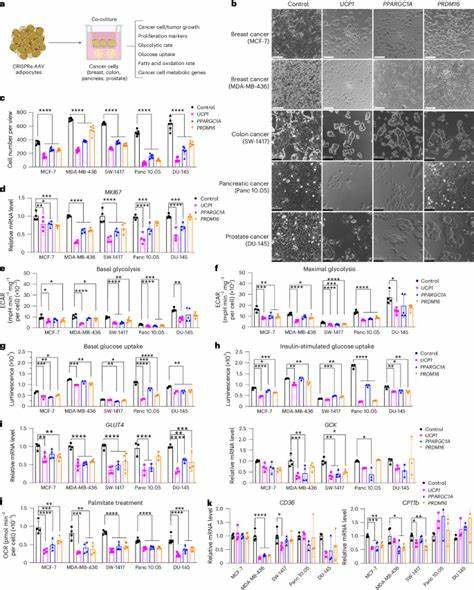
Estas modificaciones no solo incrementan el consumo de glucosa y oxidación de ácidos grasos sino que inducen un metabolismo energético elevado, generando una demanda metabólica robusta que limita la disponibilidad de nutrientes para las células cancerosas in situ o en modelos animales. Los estudios in vitro confirman que los adipocitos modificados capaces de imitar la función termogénica pueden inhibir significativamente la proliferación de diversas líneas celulares tumorales, incluyendo cánceres de mama, páncreas, colon y próstata. Este efecto se asocia a una reducción del metabolismo glicolítico y de la oxidación de ácidos grasos en las células cancerosas, mostrando como los adipocitos compiten con eficacia en la microzona compartida. Experimentos en modelos animales inmunodeficientes han demostrado que la co-transplantación de organoides adiposos modificados junto con células tumorales genera una significativa disminución en el tamaño tumoral, además de la reducción en marcadores de proliferación, hipoxia y angiogénesis. La implantación de estos organoides ofrece ventajas al mantener un ambiente tridimensional que refleja mejor la complejidad del tejido y facilita la integración celular.
La eficacia del AMT se ha puesto a prueba en modelos genéticos de cáncer de mama y páncreas que desarrollan tumores espontáneos, donde la implantación de adipocitos modificados con incremento de Ucp1 se traduce en una notable supresión del crecimiento tumoral, incluso cuando el trasplante se realiza en sitios distales al tumor. Esto sugiere que el mecanismo de competencia metabólica puede tener efectos sistémicos y no exclusivamente locales. Además, se han desarrollado versiones inducibles y controlables del sistema CRISPRa para permitir la regulación temporal de la actividad metabólica de los adipocitos implantados mediante fármacos como la tetraciclina, brindando versatilidad para adaptarse a la evolución dinámica del tumor y evitar potenciales efectos adversos. Otro avance considerable ha sido la creación de plataformas de trasplante que utilizan andamiajes tridimensionales de polímeros biocompatibles para alojar y posicionar los organoides adiposos junto a los tumores, facilitando la supervivencia celular y permitiendo la extracción o sustitución de la terapia según sea necesario. El enfoque AMT demuestra también su adaptabilidad al diseñar adipocitos modificados para competir con tumores que dependen de metabolitos específicos, como es el caso del adenocarcinoma ductal pancreático que utiliza uridina.
Mediante la activación de la enzima uridina fosforilasa 1 (UPP1) en adipocitos, se logra que estas células absorban selectivamente la uridina, privando a las células tumorales y suprimiendo eficazmente su crecimiento. Esta estrategia presenta múltiples beneficios clínicos. Primero, se aprovecha la facilidad con la que se puede obtener tejido adiposo mediante procedimientos comunes como la liposucción, así como la reconstrucción mediante trasplantes autólogos. Segundo, el bajo riesgo inmunológico de las células adiposas facilita la aceptación y la posible producción de terapias 'listas para usar'. Tercero, la capacidad de modificar estos adipocitos para diferentes necesidades metabólicas tumorales sugiere una personalización potencial de la terapia, adaptada a las características metabólicas de cada paciente y tumor.
No obstante, es crucial considerar los posibles desafíos, incluyendo el riesgo de causar caquexia por incremento excesivo del gasto energético corporal y las complicaciones inherentes a la manipulación genética y trasplantes celulares. Por ello, la incorporación de sistemas regulables y dispositivos removibles se vuelve esencial para garantizar seguridad y control clínico. A futuro, la integración de AMT con otras terapias convencionales, como quimioterapia, inmunoterapia y radioterapia, podría potenciar los efectos anticancerígenos mediante diferentes mecanismos sinérgicos. Asimismo, la ingeniería de adipocitos para secreción de factores bioactivos específicos, vesículas extracelulares terapéuticas o como vehículos para fármacos representa nuevas vías de investigación. En resumen, la implantación de adipocitos modificados mediante técnicas avanzadas de edición genética y organoides tridimensionales abre una innovadora vía terapéutica en oncología, basada en la competencia metabólica para limitar el acceso tumoral a nutrientes esenciales.
Este enfoque posee un gran potencial para tratar diferentes tipos de cáncer, incluso en fases avanzadas, con una base sólida para la personalización y control adaptativo en la clínica. La investigación continua y los ensayos clínicos serán determinantes para validar y optimizar esta estrategia, que se perfila como un complemento esencial en la lucha contra el cáncer.



![Watch Humanoid Robot Attacking Workers During Testing in Chinese Factory [video]](/images/BF32B5FD-60B8-467E-8568-D6151701D955)