El cáncer continúa representando uno de los mayores desafíos para la salud mundial, siendo fundamental el desarrollo de nuevas terapias que puedan complementar los tratamientos convencionales y mejorar la supervivencia de los pacientes. Una línea innovadora que ha emergido recientemente involucra la manipulación de células adiposas para contrarrestar el avance tumoral. Los adipocitos, comúnmente conocidos como células grasas, tienen un papel bien reconocido en la regulación metabólica y energético corporal, pero su capacidad para influir en el microambiente tumoral y competir por nutrientes esenciales los convierte en candidatos prometedores para terapias contra el cáncer. La base de esta estrategia radica en el entendimiento del metabolismo tumoral. Las células cancerosas poseen una peculiar habilidad para adaptarse y reprogramar sus vías metabólicas, facilitando así un crecimiento rápido y sostenido incluso en condiciones adversas.
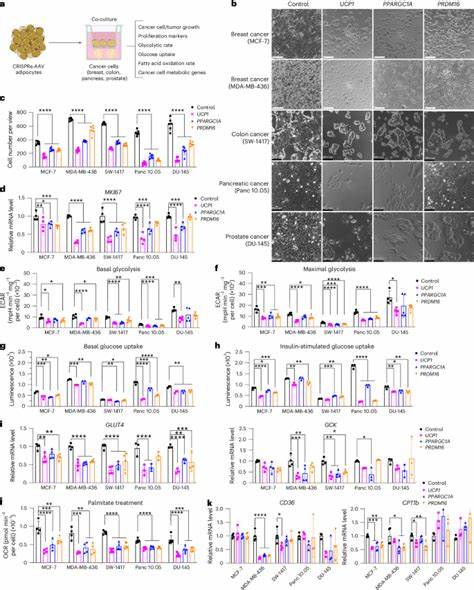
Uno de los fenómenos metabólicos más conocidos es el efecto Warburg, donde las células tumorales aumentan la captación y utilización de glucosa a través de la glucólisis aerobia, generando energía de manera eficiente para su proliferación, aunque sea en presencia de oxígeno. Además, cuando el microambiente tumoral presenta hipoxia o baja disponibilidad de glucosa, estas células pueden cambiar a la oxidación de ácidos grasos como fuente energética principal debido a que los ácidos grasos producen el doble de energía comparados con la glucosa. Frente a esta adaptación metabólica de los tumores, el implante de adipocitos modificados representa una novedosa intervención. Estas células grasas son programadas genéticamente para aumentar significativamente su captación y consumo de glucosa y lípidos, logrando así competir directamente con las células cancerígenas por estos nutrientes esenciales. Esta técnica, conocida como adipose manipulation transplantation (AMT), utiliza herramientas de activación génica basadas en CRISPR para incrementar la expresión de genes clave que promueven el fenómeno de “pardeamiento” o “beiging” del tejido adiposo blanco, convirtiéndolo en un tejido similar al adiposo marrón que caracteriza por su alta tasa metabólica y capacidad de disipar energía en forma de calor.
Los principales objetivos génicos en estos adipocitos modificados incluyen UCP1, PRDM16 y PGC1α, cuyo aumento induce un perfil metabólico semejante al del tejido adiposo marrón. UCP1, la proteína desacopladora 1, es particularmente importante porque facilita el desacoplamiento de la cadena respiratoria mitocondrial, incrementando el consumo de oxígeno y el metabolismo de lípidos y glucosa sin producir ATP, lo que lleva a una mayor demanda metabólica. Este aumento en el consumo energético hace que los adipocitos “acaparen” los nutrientes, limitando la disponibilidad para las células tumorales y por ende frenando su proliferación. Diversos estudios in vitro han demostrado que cuando diferentes líneas celulares cancerígenas, incluyendo tumores de mama, colon, páncreas y próstata, se cultivan junto a estos adipocitos modificados mediante sistemas de co-cultivo transwell, la proliferación tumoral disminuye drásticamente. Esta supresión también se corrobora mediante la reducción de marcadores de proliferación como MKI67, y connotaciones metabólicas que reflejan una disminución en la glucólisis y la oxidación de ácidos grasos dentro de las células cancerosas.
En modelos in vivo, ya sean xenoinjertos inmunodeficientes o modelos genéticos de cáncer, el coimplante de adipocitos u organoides adiposos modificados bajo la técnica CRISPRa ha mostrado una reducción significativa en el tamaño tumoral y retardo en la progresión de la enfermedad. La disminución de la angiogénesis y el estrés por hipoxia en los tumores indicaría un microambiente menos favorable para el crecimiento tumoral, probablemente por la competencia metabólica por sustratos energéticos. Es notable que la implantación de este tejido adiposo modificado puede tener eficacia incluso cuando se coloca a cierta distancia de la masa tumoral, sugiriendo mecanismos sistémicos o de alcance regional que favorecen el control metabólico del cáncer. Un aspecto crucial en la viabilidad clínica de esta técnica es la posibilidad de controlarla y personalizarla. Al utilizar un sistema inducible con tetrahidrociclinas, es posible regular la expresión de los genes terapéuticos en los adipocitos, lo que representa un importante paso para la seguridad y flexibilidad del tratamiento en el paciente.
Además, el desarrollo de plataformas de entrega, como el uso de biomateriales y microescaños fabricados con polímeros biodegradables que albergan los organoides adiposos, facilita la implantación, integración y, en caso necesario, remoción de las células terapéuticas. La versatilidad de esta tecnología también se extiende a la personalización metabólica. Por ejemplo, en adenocarcinoma ductal pancreático, donde la utilización del uridin es una vía esencial para el metabolismo tumoral, se ha demostrado que la sobreexpresión de la enzima uridina fosforilasa 1 (UPP1) en adipocitos puede suprimir eficazmente el crecimiento tumoral al competir por el uridin, subrayando el potencial para adaptar el tratamiento a las particularidades metabólicas de cada tipo tumoral. La generación de organoides derivados de tejidos humanos permite además evaluar la respuesta en un contexto más representativo y personalizado. En el caso de cáncer de mama, el uso de adipocitos modificados provenientes de tejido mamario ha demostrado frenar la progresión de organoides tumorales aislados de pacientes, incluyendo aquellos de alto riesgo como portadores de mutaciones BRCA1/2, lo cual abre la puerta a terapias autólogas ex vivo con trasplantes personalizados.
A nivel metabólico sistémico, la implantación de estos adipocitos modificados también mejora parámetros como la sensibilidad a la insulina, la tolerancia a la glucosa y reduce niveles plasmáticos de insulina, factores asociados a un ambiente metabólico menos propicio para el crecimiento y supervivencia tumoral. Esta mejora metabólica podría contribuir con efectos indirectos en la reducción tumoral, complementando la competencia directa de nutrientes. Es importante remarcar que esta estrategia aprovecha procedimientos clínicos ya bien establecidos como la liposucción y el trasplante de tejido adiposo, facilitando la posible incorporación a la práctica clínica. Sin embargo, persisten retos, como el manejo de posibles efectos adversos, entre ellos la potencial asociación con caquexia cancerosa, y la necesidad de ajustar dosis y duración para evitar impactos negativos en el organismo. En definitiva, la implantación de adipocitos modificados representa una novedosa frontera en la terapia contra el cáncer, combinando la biología metabólica con ingeniería genética y técnicas biomédicas avanzadas.
Su capacidad para interactuar con el microambiente tumoral, alterar la disponibilidad de nutrientes y modificar la dinámica metabólica sistémica abre múltiples posibilidades para nuevos tratamientos, especialmente en combinación con terapias convencionales. A medida que se profundiza en la comprensión de los mecanismos metabólicos del cáncer y se optimizan las técnicas de ingeniería celular, esta estrategia promete convertirse en una poderosa herramienta para combatir la heterogeneidad tumoral, la resistencia terapéutica y mejorar la calidad de vida de los pacientes. La personalización y el control regulable de estas células, junto con plataformas seguras de entrega, anticipan un futuro en el que el AMT (adipose manipulation transplantation) sea un componente clave en el arsenal contra el cáncer.